Đi sâu vào ung thư miễn dịch: Làm sáng tỏ các loại ung thư và đối mặt với những thách thức
Ung thư là một căn bệnh rất phức tạp có xu hướng gây ra bởi sự phát triển quá mức của các tế bào ác tính và phản ứng miễn dịch bị thay đổi. Các liệu pháp điều trị ung thư truyền thống bao gồm phẫu thuật, xạ trị, hóa trị và liệu pháp nhắm mục tiêu, nhưng không ai trong số này có thể chữa khỏi ung thư hoàn toàn.
Miễn dịch ung thư là tương đối mới trong thế giới điều trị ung thư và có thể kiểm soát và tiêu diệt các tế bào khối u bằng cách xúi giục hoặc khôi phục hệ thống miễn dịch.
Có một số hình thức điều trị miễn dịch ung thư hiện có sẵn, bao gồm thuốc ức chế điểm kiểm soát miễn dịch, vắc-xin ung thư, liệu pháp virus oncolytic, liệu pháp tế bào T và kháng thể đơn dòng. Sự kết hợp của các liệu pháp hiệu quả này có thể nâng cao đáng kể hiệu quả, dẫn đến phản ứng miễn dịch chống ung thư bền vững.1
Bài viết sau đây thảo luận về các phương pháp trị liệu miễn dịch phổ biến được sử dụng trong thực hành lâm sàng và phân tích những thách thức hiện tại trong lĩnh vực này.
Lịch sử ung thư miễn dịch
Sau hơn một thế kỷ phát triển, ung thư miễn dịch đã nổi lên như một trong những phương pháp hiệu quả nhất để điều trị ung thư. Vào cuối những năm 1890, William Coley đã tiến hành nghiên cứu tiên phong về ung thư miễn dịch, chứng minh tiềm năng của nó bằng cách sử dụng thành công tiêm vi khuẩn để điều trị ung thư.2
Trong những năm 1980, các phương pháp điều trị ung thư mới bắt đầu xuất hiện, bao gồm liệu pháp tế bào nuôi dưỡng, kháng thể nhắm mục tiêu và vắc-xin ung thư.
Năm 1989, sự ra đời của thụ thể kháng nguyên chimeric đầu tiên (CAR) đã đánh dấu một bước đột phá đáng kể trong khoa học y tế. Gần hai thập kỷ sau, vào năm 2012, Carl June đã sử dụng liệu pháp tế bào CAR-T để điều trị thành công cho một bệnh nhân mắc bệnh bạch cầu. Vào những năm 1990, các chất ức chế PD-1 / L1 đã được phát hiện và đây là loại liệu pháp miễn dịch được áp dụng rộng rãi nhất.
Trong thời gian gần đây, các chất ức chế điểm kiểm soát miễn dịch như ipilimumab, nivolumab và atezolizumab đã nhận được sự chấp thuận của Cục Quản lý Thực phẩm và Dược phẩm (FDA) để điều trị ung thư.3,4
Các loại liệu pháp miễn dịch ung thư
Liệu pháp miễn dịch đã cho thấy tiềm năng lớn trong điều trị ung thư, với các phương pháp đầy hứa hẹn được tìm thấy trong các liệu pháp tế bào nuôi (ACT), chất hấp thụ tế bào T hai đặc hiệu, thuốc ức chế điểm kiểm soát miễn dịch và vắc-xin ung thư điều trị. 5
Những cách tiếp cận này đều có chung một cơ chế hoạt động, cụ thể là bảo vệ chống lại các kháng nguyên khối u bằng cách kích thích phản ứng miễn dịch dựa trên tế bào T (Hình 1).
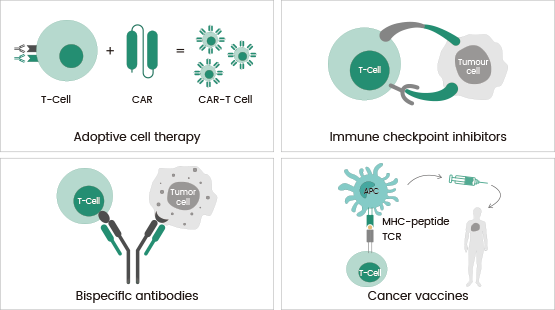
Hình 1. Các loại liệu pháp miễn dịch chính. Tín dụng hình ảnh: Sino Biological US Inc.
Liệu pháp tế bào nuôi
Liệu pháp tế bào nuôi là một phương pháp trị liệu miễn dịch thụ động. Có bốn mô hình chính của liệu pháp tế bào nuôi dưỡng, bao gồm liệu pháp tế bào lympho xâm nhập khối u (TIL), liệu pháp tế bào T thụ thể kháng nguyên chimeric (CAR), liệu pháp thụ thể tế bào T được thiết kế (TCR) và liệu pháp tế bào giết người tự nhiên (NK).
Liệu pháp TIL cô lập trực tiếp các tế bào miễn dịch của bệnh nhân, mở rộng số lượng của chúng và sau đó truyền chúng trở lại bệnh nhân. Đối với các liệu pháp tế bào TCR và CAR-T, các tế bào miễn dịch từ bệnh nhân được phân lập và biến đổi gen để nhận biết và trau dồi các kháng nguyên khối u trước khi truyền chúng trở lại bệnh nhân. 6
Thuốc ức chế điểm kiểm soát miễn dịch
Các điểm kiểm soát miễn dịch là các yếu tố bảo vệ được tìm thấy trong hệ thống miễn dịch ngăn chặn hoạt động quá mức của tế bào T, có thể dẫn đến tổn thương tự miễn. Tuy nhiên, các tế bào ung thư thường được nhìn thấy sử dụng các trạm kiểm soát này để trốn tránh sự giám sát miễn dịch.
Để giải quyết thách thức này, các nhà khoa học đã phát triển các chất ức chế điểm kiểm soát miễn dịch (ICI) để phá vỡ các con đường tín hiệu ức chế. Cách tiếp cận này giúp khôi phục giám sát miễn dịch tế bào T và tiêu diệt các tế bào khối u.7
Các mục tiêu được sử dụng rộng rãi nhất cho ICI là PD-1, PD-L1 và CTLA-4; những điều này đã chứng minh lợi ích tuyệt vời trong ung thư phổi không tế bào nhỏ (NSCLC), khối u ác tính di căn và ung thư thận.8
Liên hợp kháng thể-thuốc
Liên hợp kháng thể-thuốc (ADC) sử dụng tính đặc hiệu kháng nguyên của kháng thể đơn dòng để nhắm mục tiêu và cung cấp thuốc gây độc tế bào cho các tế bào khối u. Có 15 ADC được phê duyệt tính đến tháng 10/2023, với hơn 150 ứng cử viên trong các thử nghiệm lâm sàng.
Các nỗ lực nghiên cứu chuyên sâu đang được tiến hành để điều tra tiềm năng của việc kết hợp ADC với hóa trị, các tác nhân nhắm mục tiêu phân tử và liệu pháp miễn dịch. Trên thực tế, sự thành công của ICI đã thu hút được sự quan tâm trong việc khám phá các tải trọng ADC kích thích miễn dịch như chất chủ vận STING và chất chủ vận TLR.9
Kháng thể lưỡng đặc hiệu
Kháng thể lưỡng đặc hiệu (bsAbs) đại diện cho một nhóm kháng thể linh hoạt có nguồn gốc từ kháng thể đơn dòng, được thiết kế để liên kết hai kháng nguyên riêng biệt hoặc hai epitope riêng biệt trên cùng một kháng nguyên.
Phần lớn các bsAbs rơi vào loại tế bào T hai đặc hiệu (BiTEs), được thiết kế để nhắm mục tiêu cả kháng nguyên khối u và phân tử liên quan đến miễn dịch, do đó chuyển hướng các tế bào T đến các kháng nguyên khối u cụ thể để loại bỏ ung thư.10
Vắc-xin ung thư
Vắc-xin ung thư được thiết kế để kích hoạt phản ứng miễn dịch của cơ thể chống lại các tế bào khối u bằng cách sử dụng các kháng nguyên khối u, cuối cùng dẫn đến sự phá hủy các tế bào ung thư. Đây có thể là phòng ngừa hoặc điều trị.
Vắc-xin ung thư phòng ngừa, chẳng hạn như vắc-xin HPV và HBV (hai loại duy nhất đã được FDA chấp thuận), ức chế sự phát triển của một số bệnh ung thư.
Vắc-xin điều trị ung thư đặc biệt nhằm kích thích phản ứng của hệ thống miễn dịch chống lại các kháng nguyên khối u cụ thể, để quản lý sự phát triển của khối u hoặc thậm chí gây ra sự thoái triển khối u. Chúng chủ yếu được chia thành bốn loại: vắc-xin biến đổi gen, vắc-xin toàn tế bào khối u, vắc-xin tế bào đuôi gai và vắc-xin protein-peptide.11
Những thách thức trong ung thư miễn dịch
Liệu pháp miễn dịch như ICI và ACT là những liệu pháp miễn dịch đã cho thấy hiệu quả đầy hứa hẹn trong điều trị ung thư. Tuy nhiên, có nhiều rào cản trong ung thư miễn dịch, bao gồm các tác dụng phụ liên quan đến miễn dịch (irAEs) được phát hiện trong quá trình điều trị, một số lượng hạn chế các dấu ấn sinh học đáng tin cậy và hợp lệ để đánh giá hiệu quả lâm sàng và tỷ lệ đáp ứng khối u thấp của liệu pháp miễn dịch đơn tác nhân.
Điều đó đang được nói, liệu pháp miễn dịch ung thư kết hợp có thể làm tăng đáng kể hiệu quả, độ bền và tỷ lệ đáp ứng.12 Ví dụ, vào năm 2018, pembrolizumab kháng thể chống PD-1 kết hợp với hóa trị liệu đã được FDA chấp thuận là phương pháp điều trị đầu tay cho NSCLC, cải thiện đáng kể khả năng sống sót của bệnh nhân so với đơn trị liệu.8
Tóm tắt
Mặc dù có một lịch sử lâu dài, ung thư miễn dịch đã trải qua những tiến bộ đáng kể, chủ yếu trong những thập kỷ gần đây. Trong bài viết này, Sino Biological thảo luận về lịch sử và các loại liệu pháp miễn dịch ung thư khác nhau và những thách thức hiện tại của nó. Để cải thiện hiệu quả điều trị của liệu pháp miễn dịch ung thư, sự kết hợp của nhiều phương pháp có hiệu quả.
Dấu ấn sinh học cũng có thể hữu ích trong chẩn đoán, tiến triển và dự đoán ung thư. Liệu pháp miễn dịch cá nhân hóa có giá trị cao do các con đường điều chế đa dạng của đáp ứng miễn dịch chống ung thư và các biến thể cụ thể của bệnh nhân.
Sino Biological cung cấp các giải pháp hoàn chỉnh để phát triển liệu pháp miễn dịch ung thư, bao gồm CAR-NK, CAR-T, và các kháng thể lưỡng đặc hiệu và đa đặc hiệu.
Hơn nữa, Sino Biological đã phát triển một bộ sưu tập toàn diện gồm 1.100+ cytokine, bao gồm tất cả các họ cytokine, cũng như các sản phẩm liên quan đến vắc-xin ung thư và điểm kiểm soát miễn dịch chất lượng cao, để hỗ trợ phát triển các liệu pháp miễn dịch ung thư sáng tạo.
Sino Biological đã thiết lập nhiều nền tảng công nghệ tiên tiến để cung cấp dịch vụ CRO đầy đủ dịch vụ. Những nền tảng này bao gồm biểu hiện tế bào động vật có vú, phát triển hybridoma và khám phá tế bào B đơn lẻ, tất cả đều nhằm mục đích tăng cường phát triển và sản xuất các liệu pháp sáng tạo.
Tài liệu tham khảo và đọc thêm
- Taefehshokr N, Baradaran B, Baghbanzadeh A, Taefehshokr S. Phương pháp tiếp cận đầy hứa hẹn trong liệu pháp miễn dịch ung thư. Sinh học miễn dịch. 2020; 225(2):151875. doi:10.1016/j.imbio.2019.11.010
- Wang DR, Wu XL, Sun YL. Mục tiêu điều trị và dấu ấn sinh học của liệu pháp miễn dịch khối u: đáp ứng so với không đáp ứng. Mục tiêu truyền tín hiệu Ther. 2022; 7(1):331. doi:10.1038/s41392-022-01136-2
- Galon J, Bruni D. Miễn dịch học khối u và sự tiến hóa của khối u: Lịch sử đan xen. Miễn dịch. 2020; 52(1):55-81. doi:10.1016/j.immuni.2019.12.018
- Trương Y, Trương Z. Lịch sử và những tiến bộ trong liệu pháp miễn dịch ung thư: hiểu các đặc điểm của các tế bào miễn dịch xâm nhập khối u và ý nghĩa điều trị của chúng. Tế bào mol miễn dịch. 2020; 17(8):807-821. doi:10.1038/s41423-020-0488-6
- Dagher OK, Schwab RD, Brookens SK, Posey AD Jr. Những tiến bộ trong liệu pháp miễn dịch ung thư. Ô. 2023; 186(8):1814-1814.e1. doi:10.1016/j.cell.2023.02.039
- Vương Trạch, Tào Yểm. Liệu pháp tế bào nuôi nhắm mục tiêu neoantigens: Biên giới cho nghiên cứu ung thư. Miễn dịch phía trước. 2020;11:176. doi:10.3389/fimmu.2020.00176
- Wei G, Zhang H, Zhao H, et al. Các điểm kiểm soát miễn dịch mới nổi trong vi môi trường khối u: Ý nghĩa đối với liệu pháp miễn dịch ung thư. Ung thư Lett. 2021;511:68-76. doi:10.1016/j.canlet.2021.04.021
- Barbari C, Fontaine T, Parajuli P, et al. Liệu pháp miễn dịch và chiến lược kết hợp cho ung thư miễn dịch. Int J Mol Khoa học 2020; 21(14):5009. doi:10.3390/IJMS21145009
- Janet M. Sasso, Rumiana Tenchov, Robert Bird, et al. Bối cảnh phát triển của liên hợp kháng thể-thuốc: Phân tích sâu về tiến trình nghiên cứu gần đây. Hóa học liên hợp sinh học 2023 34 (11), 1951-2000. doi: 10.1021/acs.bioconjchem.3c00374
- Esfandiari A, Cassidy S, Webster RM. Kháng thể lưỡng đặc hiệu trong ung thư. Nat Rev ma túy Discov. 2022; 21(6):411-412. doi:10.1038/d41573-022-00040-2
- Saxena M, van der Burg SH, Melief CJM, Bhardwaj N. Vắc-xin điều trị ung thư. Nat Rev ung thư. 2021; 21(6):360-378. doi:10.1038/s41568-021-00346-0
- Marshall HT, MBA Djamgoz. Miễn dịch-ung thư: Các mục tiêu mới nổi và liệu pháp kết hợp. Mặt trước Oncol. 2018;8:315. doi:10.3389/fonc.2018.00315
Giới thiệu về Sino Biological Inc.
Sino Biological là nhà cung cấp dịch vụ và cung cấp thuốc thử quốc tế. Công ty chuyên sản xuất protein tái tổ hợp và phát triển kháng thể. Tất cả các sản phẩm của Sino Biological đều được phát triển và sản xuất độc lập, bao gồm protein tái tổ hợp, kháng thể và nhân bản cDNA. Sino Biological là cửa hàng dịch vụ kỹ thuật một cửa của các nhà nghiên cứu cho các nền tảng công nghệ tiên tiến mà họ cần để tạo ra những tiến bộ. Ngoài ra, Sino Biological cung cấp cho các công ty dược phẩm và các công ty công nghệ sinh học dịch vụ công nghệ sản xuất tiền lâm sàng cho hàng trăm ứng cử viên thuốc kháng thể đơn dòng.
Hoạt động kinh doanh cốt lõi của Sino Biological
Sino Biological cam kết cung cấp thuốc thử protein và kháng thể tái tổ hợp chất lượng cao và trở thành cửa hàng dịch vụ kỹ thuật một cửa cho các nhà nghiên cứu khoa học đời sống trên toàn thế giới. Tất cả các sản phẩm của chúng tôi được phát triển và sản xuất độc lập. Ngoài ra, chúng tôi cung cấp cho các công ty dược phẩm và các công ty công nghệ sinh học dịch vụ công nghệ sản xuất tiền lâm sàng cho hàng trăm ứng cử viên thuốc kháng thể đơn dòng. Các chỉ số kiểm soát chất lượng sản phẩm của chúng tôi đáp ứng các yêu cầu nghiêm ngặt đối với các mẫu sử dụng lâm sàng. Chỉ mất vài tuần để chúng tôi sản xuất 1 đến 30 gram kháng thể đơn dòng tinh khiết từ trình tự gen.
Chính sách nội dung được tài trợ: News-Medical.net xuất bản các bài báo và nội dung liên quan có thể bắt nguồn từ các nguồn mà chúng tôi có mối quan hệ thương mại hiện có, miễn là nội dung đó làm tăng giá trị cho đặc tính biên tập cốt lõi của News-Medical.Net đó là giáo dục và thông báo cho khách truy cập trang web quan tâm đến nghiên cứu y tế, khoa học, thiết bị y tế và phương pháp điều trị.
Mục tiêu thuốc chống ung thư: Công cụ nghiên cứu
Ung thư là một vấn đề sức khỏe quốc tế. Khoảng 19,3 triệu trường hợp ung thư mới và gần 10 triệu ca tử vong do ung thư xảy ra vào năm 2020 trên toàn cầu, theo ước tính của GLOBOCAN 2020 về tỷ lệ mắc và tử vong do ung thư như được ghi nhận trong báo cáo của Cơ quan Nghiên cứu Ung thư Quốc tế (Hình 1).1
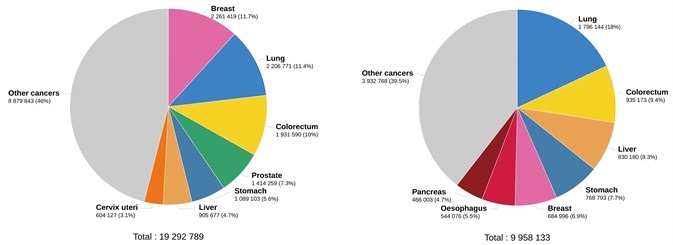
Hình 1.Ước tính số ca mắc mới trong năm 2020. Trên toàn thế giới, cả hai giới, mọi lứa tuổi (trái) và số ca tử vong ước tính vào năm 2020. Trên toàn thế giới, cả hai giới, mọi lứa tuổi (phải). (Nguồn dữ liệu: GLOBCAN 2020, Sản xuất đồ thị: Đài quan sát ung thư toàn cầu (http://gco.iarc.fr/)). ). Tín dụng hình ảnh: Sino Biological Inc.
Ngày nay, có một số phương pháp điều trị mà bệnh nhân có thể tiếp cận, bao gồm hóa trị, liệu pháp nhắm mục tiêu và liệu pháp miễn dịch. Liệu pháp nhắm mục tiêu là một loại y học chính xác, trong đó các protein ảnh hưởng đến sự phân chia, tăng trưởng và lây lan của các tế bào ung thư chủ yếu được nhắm mục tiêu.2
Đột biến BRAF V600E, protein tổng hợp BCR-ABL, HER-2 và thụ thể yếu tố tăng trưởng biểu bì (EGFR) là một trong những mục tiêu chính của các liệu pháp nhắm mục tiêu.3 Phần lớn các loại thuốc nhắm mục tiêu có thể ít nhiều được chia thành hai loại: phân tử nhỏ và kháng thể đơn dòng.4
Ví dụ, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt trastuzumab (Herceptin), một kháng thể đơn dòng được sử dụng để điều trị ung thư vú và dạ dày đặc biệt biểu hiện quá mức HER-2.®5
Chất ức chế tyrosine kinase gefitinib (Iressa) là một phân tử nhỏ, cũng được FDA chấp thuận, được sử dụng trong điều trị sớm ung thư phổi không tế bào nhỏ di căn. Mục tiêu của thuốc này là xóa EGFR exon 19 hoặc đột biến thay thế exon 21 (L858R), được xác định bởi xét nghiệm được FDA chấp thuận.®6
Liệu pháp miễn dịch có khả năng khai thác khả năng chống ung thư của chính hệ thống miễn dịch. Trong một số khối u rắn, liệu pháp miễn dịch được sử dụng như là dòng điều trị đầu tiên.7
Các protein điểm kiểm soát của hệ thống miễn dịch có thể được coi là mục tiêu điều trị mạnh mẽ.8 Ví dụ, trên bề mặt tế bào T, protein chết tế bào được lập trình-1 (PD-1) là một protein điểm kiểm soát và phối tử chết được lập trình 1 (PD-L1) là một protein điểm kiểm soát miễn dịch biểu hiện quá mức trên bề mặt tế bào khối u.
Cách PD-1 và PD-L1 tương tác cho phép các tế bào khối u né tránh các phản ứng miễn dịch qua trung gian tế bào T. Một số liệu pháp phong tỏa PD-1 / PD-L1 dựa trên kháng thể đã thể hiện một số lợi ích trong điều trị nhiều bệnh ung thư ở người.9
FDA trước đây đã phê duyệt các kháng thể điều trị nhắm vào các thành phần điểm kiểm soát miễn dịch (Bảng 1).10
Bảng 1. Mục tiêu trạm kiểm soát và phương pháp điều trị được FDA chấp thuận. Nguồn: Sino Biological Inc.
| Mục tiêu | Điều trị được FDA chấp thuận |
|---|---|
| PD-1 | • nivolumab (Opdivo) • pembrolizumab (Keytruda®®) |
| PD-L1 | • atezolizumab (Tecentriq) • durvalumab (Imfinzi)
• avelumab (Bavencio®®®) |
Hiện tại, các nhà nghiên cứu đang đánh giá các mục tiêu mới, bao gồm thụ thể miễn dịch tế bào T với miền Ig và ITIM (TIGIT). Trong các mô hình chuột bị ung thư, sự đồng phong tỏa kháng thể của TIGIT và PD-L1 khuếch đại chức năng hiệu ứng tế bào T CD8 và ức chế sự phát triển của khối u.+11
Vào tháng 1 năm 2021, dựa trên dữ liệu từ thử nghiệm CITYSCAPE giai đoạn II, Roche tuyên bố rằng sự kết hợp giữa tiragolumab (một kháng thể chống TIGIT) và atezolizumab đã chứng minh hiệu quả và an toàn đầy hứa hẹn trong ung thư biểu mô phổi không tế bào nhỏ di căn dương tính với PD-L1.12
Cả hai liệu pháp nhắm mục tiêu phân tử nhỏ và liệu pháp miễn dịch đã chứng minh kết quả lâm sàng rất đáng nể. Hơn nữa, kết hợp hai phương pháp này mang lại tiềm năng kích thích kết quả hiệp đồng và lâu dài ở bệnh nhân.
Ví dụ, kết quả từ một thử nghiệm lâm sàng giai đoạn II ngẫu nhiên của dabrafenib kết hợp (nhắm mục tiêu BRAF V600E), trametinib (nhắm mục tiêu BRAF V600E hoặc V600K) và pembrolizumab cho thấy kết quả đầy hứa hẹn, bao gồm tỷ lệ sống sót không tiến triển tốt hơn và cải thiện đáp ứng, ở những bệnh nhân được dùng cả ba loại thuốc so với những người chỉ dùng dabrafenib và trametinib.
Tuy nhiên, sự kết hợp ba cũng cho thấy một loạt tác dụng phụ.13
Protein mục tiêu thuốc tái tổ hợp
Như dữ liệu trong Hình 2 cho thấy, ung thư phổi là nguyên nhân chính gây tử vong do ung thư ở cả hai giới, với khoảng 1,8 triệu ca tử vong (18%), tiếp theo là ung thư đại trực tràng (9,4%), gan (8,3%) và dạ dày (7,7%). Loại ung thư phổi thường gặp nhất là ung thư phổi không tế bào nhỏ (NSCLC).
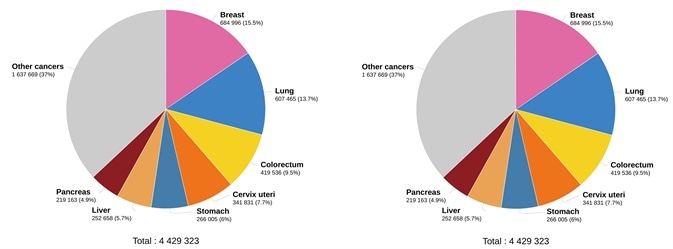
Hình 2.Ước tính số ca tử vong năm 2020. Trên toàn thế giới, cả hai giới, mọi lứa tuổi (trái) và số ca tử vong ước tính vào năm 2020. Trên toàn thế giới, nữ giới, mọi lứa tuổi (phải). (Nguồn dữ liệu: GLOBCAN 2020, Sản xuất đồ thị: Đài quan sát ung thư toàn cầu (http://gco.iarc.fr/)). Tín dụng hình ảnh: Sino Biological Inc.
Trên toàn thế giới, ung thư vú là loại ung thư nguy hiểm nhất ở phụ nữ (15,5%) (Hình 2). EGFR đã tham gia vào sinh bệnh học của nhiều khối u ác tính ở người, bao gồm ung thư đại trực tràng (CRC), NSCLC, ung thư biểu mô tế bào vảy đầu và cổ (HNSCC) và ung thư vú.14
Dữ liệu này đã thúc đẩy sự phát triển của một số chất ức chế EGFR được FDA chấp thuận chống lại các bệnh ung thư như vậy.15 Miền ngoại bào của EGFR là mục tiêu của các kháng thể ngăn chặn phối tử EGFR cetuximab và panitumumab.14
Gefitinib và erlotinib là các chất ức chế tyrosine kinase tương tác với miền nội bào của EGFR.16 Do đó, nên phát triển các sản phẩm bao gồm miền ngoại bào hoặc nội bào của các protein này (Hình 3).
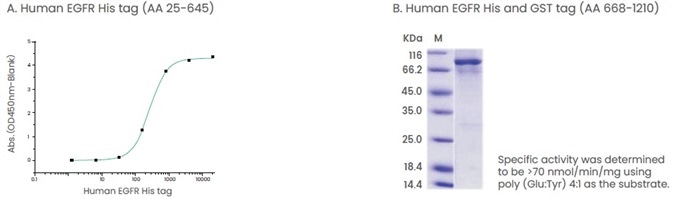
Hình 3. Ví dụ về các sản phẩm có chứa miền ngoại bào hoặc miền nội bào của protein. (A) Thử nghiệm liên kết của EGF và EGFR. EGF hFc cố định của con người (Cat: 10605-H01H) ở 2 μg / ml (100 μl / giếng) có thể liên kết EGFR của con người (Cat: 10001-H08H). (B) Thử nghiệm hoạt động cụ thể của EGFR (AA 668-1210). Tín dụng hình ảnh: Sino Biological Inc.
Các tế bào khối u có thể bỏ qua sự phát hiện bằng cách tự bảo vệ mình chống lại hệ thống miễn dịch. Điều này được thực hiện bằng cách kích hoạt các con đường tín hiệu thông qua liên kết thụ thể phối tử. Các tương tác thụ thể-phối tử làm suy yếu khả năng miễn dịch chống ung thư.17
Ví dụ, trong một số loại ung thư, sự liên kết của CD47 (phối tử) để báo hiệu α protein điều hòa (SIRPα) (thụ thể) kích hoạt một con đường tín hiệu ức chế cho phép các tế bào ác tính trốn tránh sự loại bỏ thực bào bởi các đại thực bào.18
Một số kháng thể điều trị điểm kiểm soát miễn dịch tăng cường hoạt động chống ung thư bằng cách cản trở liên kết thụ thể phối tử. Các kháng thể điều trị ngăn chặn PD-1 và phối tử PD-L1 của nó trước đây đã cho thấy hiệu quả lâm sàng,19 và kháng thể chống CD47 đã chứng minh khả năng tăng cường thực bào của các tế bào khối u bằng cách cản trở sự liên kết của CD47 với SIRPα.18
Do đó, khi thiết kế các công cụ để hỗ trợ các nỗ lực nghiên cứu này, điều cực kỳ quan trọng là phải xem xét các cặp phối tử-thụ thể (Hình 4).

Hình 4. Ví dụ về protein cặp thụ thể phối tử. (A) Xét nghiệm liên kết CD47 và SIRP_. SIRP hFc cố định của con người (Cat: 11612-H02H1) ở 2 μ g / ml (100 μ l / well) có thể liên kết CD47 của con người (Cat: 12283-H08H). (B) Thử nghiệm liên kết của TIGIT và CD155. CD155 / PVR cố định của con người (Cat: 10109-H08H) ở 2 μ g / mL (100 μl / well) có thể liên kết TIGIT của con người biotinyl hóa (hFc &; AVI Tag) (Cat: 10917-H41H-B). Tín dụng hình ảnh: Sino Biological Inc.
Cytokin
Nó có thể là trường hợp các xét nghiệm chức năng của kháng thể phải được thử nghiệm trên các tế bào. Cytokine thường được sử dụng trong các xét nghiệm chức năng như vậy. Ví dụ, TIGIT được biểu hiện trên các tế bào T và NK, được phân loại là tác nhân chống ung thư.20,21
TIGIT cản trở tác dụng tiêu diệt của tế bào NK trên tế bào khối u, trong khi chức năng của tế bào NK và T được phục hồi bằng cách ngăn chặn TIGIT.22
Khi tiến hành các xét nghiệm chức năng phong tỏa tế bào NK và TIGIT, cytokine IL-12 hoặc hỗn hợp cytokine (IL-12, IL-15 và IL-18) được thêm vào để kích thích tế bào NK. 22,23 Một loạt các cytokine đã được phát triển để tạo điều kiện cho một loạt các xét nghiệm chức năng.
Tham khảo
- Hyuna Sung và cộng sự, “Global Cancer Statistics 2020: GLOBOCAN Estimates of Incincence and Mortality Worldwide for 36 Cancers in 185 Countries,” CA: A Cancer Journal for Clinicians n/a, no. n/a, truy cập ngày 7 tháng 2 năm 2021, https://doi.org/10.3322/caac.21660.
- “Liệu pháp nhắm mục tiêu cho bệnh ung thư – Viện Ung thư Quốc gia,” cgvArticle, ngày 15 tháng 8 năm 2014, nciglobal,ncienterprise, https://www.cancer.gov/about-cancer/treatment/types/targeted-therapies.
- William N. Hait, “Targeted Cancer Therapeutics,” Cancer Research 69, no. 4 (ngày 15 tháng 2 năm 2009): 1263–67, https://doi.org/10.1158/0008-5472.CAN-08-3836.
- Lei Zhong và cộng sự, “Các phân tử nhỏ trong liệu pháp ung thư nhắm mục tiêu: Tiến bộ, thách thức và triển vọng tương lai,” Truyền tín hiệu và liệu pháp nhắm mục tiêu 6, số 1 (2021): 1–48, https://doi.org/10.1038/s41392-021-00572-w.
- “Herceptin (Trastuzumab) FDA Approval History,” Drugs.com, truy cập ngày 10 tháng 1 năm 2022, https://www.drugs.com/history/herceptin.html.
- “Iressa (Gefitinib) FDA Approval History – Drugs.Com,” truy cập ngày 10 tháng 1 năm 2022, https://www.drugs.com/history/iressa.html.
- Raju K. Vaddepally và cộng sự, “Đánh giá các chỉ định về chất ức chế điểm kiểm soát miễn dịch được FDA chấp thuận theo Hướng dẫn NCCN với mức độ bằng chứng,” Cancers 12, số 3 (ngày 20 tháng 3 năm 2020), https://doi.org/10.3390/cancers12030738.
- P. Zatloukalová et al., “[Vai trò của con đường tín hiệu PD-1 / PD-L1 trong phản ứng miễn dịch chống ung thư],” Klinicka Onkologie: Casopis Ceske a Slovenske Onkologicke Spolecnosti 29 Suppl 4, không. Suppl 4 (Mùa thu 2016): 72–77.
- Hyun Tae Lee và cộng sự, “Cơ chế phân tử của phong tỏa PD-1 / PD-L1 thông qua kháng thể chống PD-L1 Atezolizumab và Durvalumab,” Báo cáo khoa học 7 (ngày 17 tháng 7 năm 2017), https://doi.org/10.1038/s41598-017-06002-8.
- Hyun Tae Lee, Sang Hyung Lee và Yong-Seok Heo, “Tương tác phân tử của thuốc kháng thể nhắm mục tiêu PD-1, PD-L1 và CTLA-4 trong ung thư miễn dịch,” Phân tử 24, số 6 (ngày 26 tháng 3 năm 2019), https://doi.org/10.3390/molecules24061190.
- Francesco Passiglia và cộng sự, “Immune-Checkpoint Inhibitors Combinations in Metastatic NSCLC: New Options on the Horizon?,” ImmunoTargets and Therapy 10 (ngày 5 tháng 2 năm 2021): 9–26, https://doi.org/10.2147/ITT.S253581.
- “Tiragolumab chống TIGIT mới của Genentech đã cấp chỉ định liệu pháp đột phá của FDA kết hợp với tecentriq cho ung thư phổi không tế bào nhỏ PD-L1 cao,” ngày 5 tháng 1 năm 2021, https://www.businesswire.com/news/home/20210104005887/en/Genentech%E2%80%99s-Novel-Anti-TIGIT-Tiragolumab-GrantedFDA-Breakthrough-Therapy-Designation-in-Combination-With-Tecentriq-for-PD-L1-High-Non-Small-Cell-Lung-Cancer.
- Johann S. Bergholz và cộng sự, “Tích hợp liệu pháp miễn dịch và liệu pháp nhắm mục tiêu trong điều trị ung thư: Những hiểu biết cơ học và ý nghĩa lâm sàng,” Nghiên cứu ung thư lâm sàng 26, số 21 (ngày 1 tháng 11 năm 2020): 5557–66, https://doi.org/10.1158/1078-0432.CCR-19-2300.
- Deric L. Wheeler, Emily F. Dunn và Paul M. Harari, “Hiểu về khả năng kháng thuốc ức chế EGFR — Tác động đến các chiến lược điều trị trong tương lai”, Nature Reviews. Clinical Oncology 7, no. 9 (September 2010): 493–507, https://doi.org/10.1038/nrclinonc.2010.97.
- Remah Ali và Michael K. Wendt, “Các chức năng nghịch lý của EGFR trong quá trình tiến triển ung thư vú,” Truyền tín hiệu và liệu pháp nhắm mục tiêu 2, số 1 (2017): 1–7, https://doi.org/10.1038/sigtrans.2016.42.
- “Đóng góp của dị hợp tử hóa EGFR và ErbB-3 đối với kháng gefitinib và erlotinib gây đột biến EGFR trong phương pháp điều trị ung thư biểu mô phổi không tế bào nhỏ,” PLOS ONE 10, số 5 (ngày 20 tháng 5 năm 2015): e0128360, https://doi.org/10.1371/journal.pone.0128360.
- H. Harjunpää và C. Guillerey, “TIGIT như một điểm kiểm soát miễn dịch mới nổi,” Miễn dịch học lâm sàng &thực nghiệm 200, số 2 (2020): 108–19, https://doi.org/10.1111/cei.13407.
- Wenting Zhang và cộng sự, “Những tiến bộ trong phương pháp điều trị chống khối u nhắm vào trục CD47 / SIRPα,” Frontiers in Immunology 11 (2020), https://doi.org/10.3389/fimmu.2020.00018.
- Zatloukalová et al., “[Vai trò của con đường tín hiệu PD-1 / PD-L1 trong phản ứng miễn dịch chống ung thư].”
- Theresa L. Whiteside và Ronald B. Heberman, “Tế bào hiệu ứng chống ung thư ở người”, Thuốc ung thư Holland-Frei. Ấn bản lần thứ 6, 2003, https://www.ncbi.nlm.nih.gov/books/NBK13070/.
- “TIGIT – Tổng quan | ScienceDirect Topics,” truy cập ngày 29 tháng Ba năm 2021, https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/tigit.
- Fanqiao Meng và cộng sự, “Biểu hiện quá mức của TIGIT trong tế bào NK và T góp phần thoát khỏi miễn dịch khối u trong hội chứng myelodysplastic,” Frontiers in Oncology 10 (2020), https://doi.org/10.3389/fonc.2020.01595.
- Xiaowan Yin và cộng sự, “Biểu hiện của thụ thể ức chế TIGIT được điều chỉnh đặc biệt trên các tế bào NK với thụ thể kích hoạt CD226 từ những người nhiễm HIV,” Frontiers in Immunology 9 (2018), https://doi.org/10.3389/fimmu.2018.02341.
Điều trị ung thư: Khám phá các liệu pháp cytokine và anticytokine khác nhau
Ung thư được coi là một vấn đề sức khỏe cộng đồng quan trọng trên toàn thế giới. Một số nghiên cứu cơ bản và thử nghiệm lâm sàng đã chỉ ra rằng liệu pháp miễn dịch là một trong những phương pháp điều trị hiệu quả và hy vọng nhất để điều trị ung thư.
Liệu pháp miễn dịch ung thư kích hoạt hệ thống miễn dịch của cơ thể và cải thiện phản ứng miễn dịch chống ung thư để chống lại các tế bào ung thư. Nó bao gồm nhiều chiến lược, chẳng hạn như thuốc ức chế điểm kiểm soát miễn dịch, liệu pháp cytokine, kháng thể đơn dòng điều trị nhắm vào kháng nguyên khối u, liệu pháp tế bào (ví dụ, tế bào CAR-T) và vắc-xin ung thư.
Ngoài ra, nhắm mục tiêu cytokine hoặc thụ thể cytokine đã phát sinh như liệu pháp miễn dịch ung thư có thể với sự trợ giúp của các nghiên cứu chuyên sâu về cytokine trong bệnh ung thư.
Cytokine là một lớp protein nhỏ (thường là <30 kDa) thể hiện một số hoạt động sinh học và được tổng hợp và tiết ra bởi các tế bào miễn dịch và một vài tế bào không miễn dịch (ví dụ, tế bào biểu bì, tế bào nội mô và nguyên bào sợi).
Cytokine làm trung gian giao tiếp giữa các tế bào theo cách paracrine hoặc autocrine. Điều này giúp kiểm soát sự biệt hóa, tăng sinh, tồn tại và chức năng tác động của các tế bào miễn dịch. Dựa trên chức năng của chúng, cytokine có thể được phân loại thành interferon (IFN), interleukin (IL), yếu tố kích thích khuẩn lạc (CST), yếu tố hoại tử khối u (TNF) và chemokine.
Mạng lưới cytokine trong vi môi trường khối u
Môi trường vi mô khối u (TME) là một hệ thống phức tạp và kết hợp của các tế bào nội mô, nguyên bào sợi, ma trận ngoại bào, tế bào miễn dịch và cytokine trải dài trên các tế bào ung thư. Sự tương tác của các tế bào ung thư dường như không đổi với môi trường vi mô bao quanh.
Đáng chú ý, cytokin làm trung gian giao tiếp giữa các tế bào giữa một số tế bào này trong TME theo cách paracrine hoặc autocrine (Hình 1).1
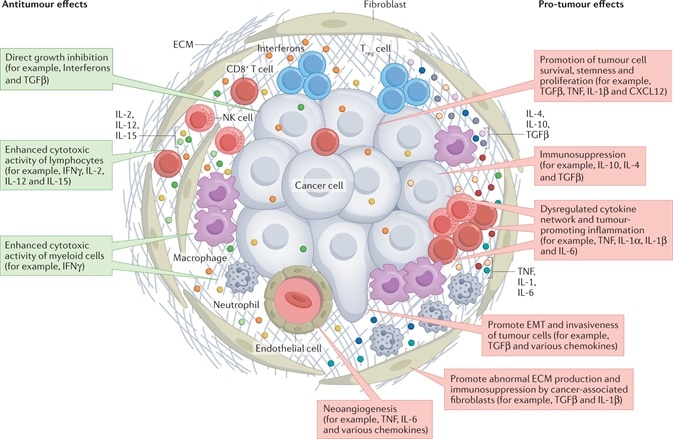 Hình 1. Mạng lưới cytokine trong TME. Các hành động của các cytokine được thể hiện trong hình chữ nhật màu đỏ và màu xanh lá cây, cho thấy tác dụng chống khối u và tác dụng chống khối u, tương ứng1. Tín dụng hình ảnh: doi: 10.1038 / s41571-021-00588-9
Hình 1. Mạng lưới cytokine trong TME. Các hành động của các cytokine được thể hiện trong hình chữ nhật màu đỏ và màu xanh lá cây, cho thấy tác dụng chống khối u và tác dụng chống khối u, tương ứng1. Tín dụng hình ảnh: doi: 10.1038 / s41571-021-00588-9
Theo như TME có liên quan, một vài cytokine đặc biệt, như IFNγ, IL-2, IL-12 và IL-15, minh họa tác dụng chống ung thư bằng cách trực tiếp cản trở sự phát triển của tế bào hoặc cải thiện tác dụng gây độc tế bào của tế bào lympho và / hoặc tế bào tủy.
Đồng thời, một vài cytokine biểu hiện bất thường cho thấy tác dụng thúc đẩy khối u theo nhiều cách, như tân sinh mạch, thúc đẩy sự sống sót của tế bào ung thư, gốc, ức chế miễn dịch và tăng sinh.
Các cytokine không điển hình như vậy có thể được tạo ra bởi các tế bào mô đệm, tế bào miễn dịch và thậm chí cả tế bào ác tính, và chúng có thể được đưa vào tất cả các giai đoạn xuất hiện và tiến triển của ung thư.
Dựa trên tác động chống ung thư hoặc protumor của các cytokine khác nhau, hai chiến lược liệu pháp miễn dịch dựa trên cytokine mâu thuẫn được sử dụng để điều trị ung thư: (1) liệu pháp cytokine, trong đó các dẫn xuất cytokine hoặc cytokine tái tổ hợp có tác dụng chống ung thư được sử dụng trực tiếp để chống lại các tế bào ung thư và (2) liệu pháp anticytokine, trong đó các chất đối kháng cytokine hoặc thụ thể cytokine được kiểm soát để hạn chế tác dụng protumor của cytokine.
Liệu pháp cytokine
Trong bốn thập kỷ qua, một số nghiên cứu lâm sàng và tiền lâm sàng đã cố gắng khai thác trực tiếp cytokine có tác dụng chống ung thư để điều trị ung thư, và rất ít nghiên cứu cho thấy kết quả hy vọng. Hiện nay, hai loại thuốc cytokine đã được phê duyệt để điều trị lâm sàng ung thư: IFN alfa-2b (Intron A) và aldesleukin (Proleukin) (Bảng 1).
Bảng 1. Thuốc Cytokine được FDA chấp thuận. Nguồn: Sino Biological Inc.
| Cytokin | Sản phẩm bàn giao | Tên thương hiệu | Ngày phê duyệt | Dấu hiệu |
|---|---|---|---|---|
| IFN-α | Interferon ALFA-2b | Intron A | 06/04/1986 | Bệnh bạch cầu tế bào lông, u ác tính ác tính, u lympho nang, sarcoma Kaposi liên quan đến AIDS |
| IL-2 | Aldesleukin | Proleukin | 05/05/1992 | Ung thư biểu mô tế bào thận di căn, u ác tính di căn |
Intron A được phép điều trị khối u ác tính, u lympho nang, bệnh bạch cầu tế bào lông và sarcoma Kaposi liên quan đến AIDS,2 trong khi Proleukin được chứng nhận để điều trị khối u ác tính di căn và ung thư biểu mô tế bào thận di căn (RCC).3
Một số cytokine khác được xác định là liệu pháp cytokine có thể. Ví dụ, như một cytokine chống ung thư, IL-12 làm tăng sự tăng sinh và hoạt động gây độc tế bào của các tế bào giết người tự nhiên và tế bào T, đồng thời cải thiện sự biệt hóa tế bào TH1 và sản xuất IFNγ.
Trong một số thử nghiệm lâm sàng, IL-12 tái tổ hợp đã cho thấy tác dụng chống ung thư khiêm tốn. Nhưng tính dễ lây lan và thời gian bán hủy ngắn của nó cản trở sự chấp thuận của nó cho ứng dụng lâm sàng.
Hiện nay, nhiều chiến lược, như liên hợp protein với polyethylene glycol và protein tổng hợp kháng thể-cytokine, đang được sử dụng cho kỹ thuật IL-12 để kéo dài thời gian bán hủy và giảm độc tính của nó.
Trong các nghiên cứu được thực hiện, các cytokine tái tổ hợp có độ tinh khiết và hoạt tính cao rất quan trọng đối với một số xét nghiệm chức năng, như xét nghiệm độc tính tế bào và thí nghiệm đối chứng của các ứng cử viên thuốc cytokine.
Sino Biological cung cấp một bộ sưu tập phong phú các cytokine tái tổ hợp trải dài trên tất cả các họ cytokine có độ tinh khiết cao, hoạt tính cao và đa nhãn (Hình 2).
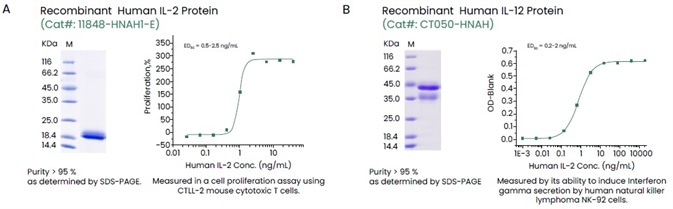 Hình 2. Ví dụ về chất lượng cao tái tổ hợp của con người IL-2 và IL-12. Tín dụng hình ảnh: Sino Biological Inc.
Hình 2. Ví dụ về chất lượng cao tái tổ hợp của con người IL-2 và IL-12. Tín dụng hình ảnh: Sino Biological Inc.
Liệu pháp kháng cytokin
Các liệu pháp anticytokine, đặc biệt là những liệu pháp nhắm vào TNF và IL-6, được sử dụng rộng rãi trong điều trị lâm sàng một số bệnh tự miễn và viêm. Thành công lớn của các liệu pháp anticytokine trong lĩnh vực miễn dịch học đã góp phần đáng kể vào việc sử dụng rộng rãi trong lĩnh vực ung thư.
Theo một số nghiên cứu tiền lâm sàng, các kháng thể đơn dòng trung hòa hoặc chất đối kháng nhắm vào các cytokine có tác dụng protumor hoặc thụ thể của chúng hiển thị các hoạt động chống ung thư. Hơn nữa, TNF là một cytokine tiền viêm với tác dụng thúc đẩy khối u.
Do đó, kháng thể đối với TNF được sử dụng để liên kết TNF biểu hiện bất thường để điều trị ung thư. Infliximab là một kháng thể đơn dòng chống TNF được chấp thuận cho nhiều bệnh tự miễn.
Một thử nghiệm lâm sàng giai đoạn I tiết lộ rằng infliximab tương thích cao và cho thấy không có tác dụng độc hại giới hạn liều ở bệnh nhân ung thư tiến triển.4 Trong hai thử nghiệm lâm sàng giai đoạn II tuần tự, ba trong số 37 bệnh nhân mắc RCC đã đạt được đáp ứng một phần và 14 bệnh nhân đạt được bệnh ổn định.5
Do đó, infliximab có thể có hiệu quả đối với RCC, nhưng nó vẫn cần được xác nhận trong các thử nghiệm lâm sàng bổ sung. IL-6 đóng vai trò gây viêm và thúc đẩy khối u trong TME. Do đó, các tác nhân nhắm mục tiêu IL-16 hoặc thụ thể của nó có thể là các loại thuốc ung thư tiềm năng.
Ví dụ, siltuximab, một kháng thể đơn dòng đã được phê duyệt đối với IL-6, đã được sử dụng trong một thử nghiệm lâm sàng giai đoạn II liên quan đến 18 bệnh nhân ung thư buồng trứng kháng bạch kim.6 Trong số những bệnh nhân như vậy, một người cho thấy đáp ứng một phần và bảy người có bệnh ổn định. Điều trị bằng siltuximab cũng làm giảm đáng kể nồng độ CCL2, CXCL12 và VEGF trong huyết tương.
Sino Biological đã đưa ra một loạt các thuốc thử chất lượng cao, chẳng hạn như protein thụ thể, kháng thể, cytokine tái tổ hợp và bộ dụng cụ ELISA để giúp hỗ trợ các liệu pháp kháng cytokine (Hình 3). Thuốc thử chất lượng cao như vậy đã được xác nhận với sự trợ giúp của một số kỹ thuật để mang lại kết quả liên tục và có thể tái tạo.
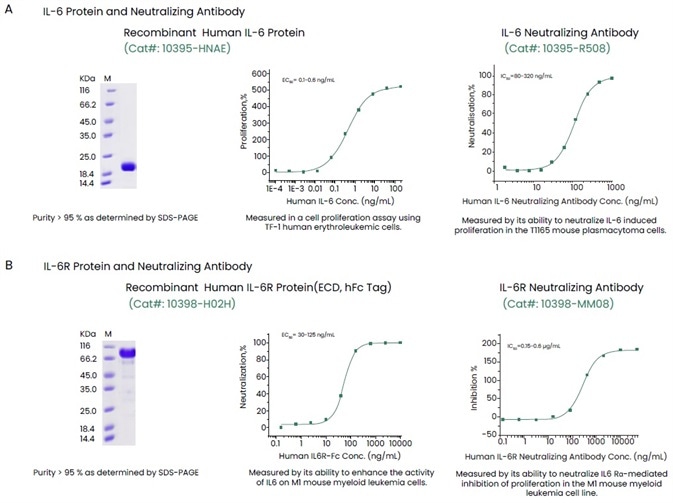 Hình 3. Ví dụ về chất lượng cao IL-6, IL-6R và kháng thể của chúng. Tín dụng hình ảnh: Sino Biological Inc.
Hình 3. Ví dụ về chất lượng cao IL-6, IL-6R và kháng thể của chúng. Tín dụng hình ảnh: Sino Biological Inc.
Tham khảo
- Propper DJ, Balkwill FR. Khai thác cytokine và chemokine để điều trị ung thư. Thiên nhiên đánh giá ung thư lâm sàng. 2022; 10.1038 / S41571-021-00588-9. doi.org/10.1038/s41571-021-00588-9
- THÔNG TIN SẢN PHẨM INTRON A (Interferon alfa-2b). www.fda.gov, truy cập ngày 21 tháng 1 năm 2022. ID tham chiếu: 4160510
- THÔNG TIN SẢN PHẨM PROLEUKIN (aldesleukin). www.fda.gov, truy cập ngày 21 tháng 1 năm 2022. ID tham chiếu: 3165255
- Brown ER, Charles KA, Hoare SA, et al. Một nghiên cứu lâm sàng đánh giá khả năng dung nạp và tác dụng sinh học của infliximab, một chất ức chế TNF-alpha, ở những bệnh nhân ung thư tiến triển. Biên niên sử ung thư. 2008; 19(7):1340-1346. doi.org/10.1093/annonc/mdn054
- Harrison ML, Obermueller E, Maisey NR, et al. Yếu tố hoại tử khối u alpha là mục tiêu mới cho ung thư biểu mô tế bào thận: hai thử nghiệm giai đoạn II tuần tự của infliximab ở liều tiêu chuẩn và cao. Tạp chí Ung thư lâm sàng. 2007; 25(29):4542-4549. doi.org/10.1200/JCO.2007.11.2136
- Hèn nhát J, Kulbe H, Chakravarty P, et al. Interleukin-6 là mục tiêu điều trị trong ung thư buồng trứng ở người. Nghiên cứu ung thư lâm sàng, 2011; 17 (18):6083-6096. doi.org/10.1158/1078-0432.CCR-11-0945