Cannabidiol là thuốc chống ung thư tiềm năng – theo thư viện Y khoa Hoa Kỳ
Cannabidiol là thuốc chống ung thư tiềm năng
trừu tượng
Trong những năm qua, một số dòng bằng chứng ủng hộ tác dụng chống độc của cannabinoids bao gồm Δ 9 -tetrahydrocannabinol (Δ 9 -THC), chất chủ vận tổng hợp, endocannabinoid và chất ức chế vận chuyển endocannabinoid. Thật vậy, cannabinoids có tác dụng chống tăng sinh và prooptotic và chúng được biết là can thiệp vào quá trình tân mạch khối u, di chuyển tế bào ung thư, bám dính, xâm lấn và di căn. Tuy nhiên, việc sử dụng lâm sàng Δ 9 -THC và các chất chủ vận cannabinoid bổ sung thường bị hạn chế bởi tác dụng phụ tâm sinh lý không mong muốn của họ, và vì lý do này quan tâm đến các hợp chất cannabinoid không hoạt động với ái lực cấu trúc cho Δ 9-THC, chẳng hạn như cannabidiol (CBD), đã tăng đáng kể trong những năm gần đây. Tổng quan hiện tại sẽ tập trung vào hiệu quả của CBD trong việc điều chế các bước khác nhau của u nguyên bào trong một số loại ung thư và nhấn mạnh tầm quan trọng của việc khám phá các chất tương tự CBD / CBD như là các tác nhân điều trị thay thế.
Hệ thống endocannabinoid: tổng quan ngắn gọn
Hệ thống endocannabinoid (eCB) là một hệ thống tín hiệu được phát hiện gần đây bao gồm các thụ thể cannabinoid CB 1 và CB 2 , các phối tử lipid nội tại của chúng, endocannabinoid (eCBs), như N-arachidonoyletanol -AG), và các máy móc enzyme liên quan (vận chuyển, enzyme sinh tổng hợp và thoái hóa).
Các thụ thể CB 1 và CB 2 cannabinoid đều là các thụ thể kết hợp protein G : Các thụ thể CB 1 phân bố cao trong hệ thần kinh trung ương (CNS), với biểu hiện thấp đến trung bình ở ngoại vi, trong khi thụ thể CB 2 cao trong hệ thống miễn dịch, với phân phối hạn chế và thấp hơn nhiều trong CNS [ 1 , 2 ].
Các phối tử nội sinh cho các thụ thể cannabinoid đã được phát hiện ngay sau khi đặc tính của chúng. Hai phối tử nội sinh chính được biết đến là anandamide (AEA) và 2-AG [ 3 – 6 ]. Cả hai đều là dẫn xuất axit arachidonic được sản xuất từ tiền chất phospholipid thông qua hoạt hóa phụ thuộc hoạt động của các enzyme phospholipase cụ thể [ 7 ]. Sau đó, một số phối tử eCB khác đã được phát hiện, bao gồm N-arachidonoyldopamine, N-arachidonoylglycerolether và O-arachidonoylethanolamine [ 8 ].
AEA và 2-AG không chia sẻ cùng một lộ trình sinh tổng hợp hoặc trao đổi chất. Các con đường khác nhau có thể tạo ra AEA từ tiền chất phospholipid N-arachidonoyl-phosphatidylethanolamine, quan trọng nhất là chuyển đổi trực tiếp được xúc tác bởi một phosphodiesterase chọn lọc N-acyl-phosphatidyletanolamine. 2-AG được tổng hợp chủ yếu thông qua hoạt hóa phospholipase C và sản xuất diacylglycerol sau đó, được chuyển thành 2-AG bởi diacylglycerol lipase. Sau khi tái hấp thu, AEA bị thủy phân bởi enzyme axit béo amide hydrolase (FAAH), tạo ra axit arachidonic và ethanolamine, trong khi 2-AG được chuyển hóa chủ yếu bởi monoacylglycerol lipase, dẫn đến sự hình thành axit arachidonic và glycerol [ 9 ]. Ngoài ràng buộc với CB 1 và CB 2thụ thể, eCB có thể liên kết với các thụ thể khác. Ví dụ, AEA có thể kích hoạt nội bào loại thụ thể vanilloid tiềm năng loại 1 (TRPV1) [ 10 ]. Hơn nữa, các thụ thể cannabinoid giả định khác là thụ thể kết hợp protein G ‘mồ côi’, GPR55 [ 11 ] và thụ thể kích hoạt proliferator kích hoạt peroxisome, PPAR [ 12 , 13 ]. Tuy nhiên, thụ thể CB 1 và CB 2 chắc chắn là mục tiêu được biết đến nhiều nhất đối với AEA và 2-AG, kích hoạt chúng với ái lực khác nhau. AEA có ái lực cao nhất trong cả hai trường hợp, trong khi 2-AG có hiệu quả cao nhất trong cả hai trường hợp [ 14 ].
Kích thích sinh lý hoặc bệnh lý gây ra sự tổng hợp và giải phóng endocannabinoids, sau đó có thể kích hoạt thụ thể cannabinoid. Do đó, các eCB được tổng hợp và giải phóng ‘theo yêu cầu’ thông qua sự phân cắt của tiền chất phospholipid màng.
Do đó, đa xơ cứng và tổn thương tủy sống, đau thần kinh, ung thư, xơ vữa động mạch, đột quỵ, nhồi máu cơ tim, tăng huyết áp, tăng nhãn áp, hội chứng béo phì / chuyển hóa và loãng xương là một số bệnh trong đó thay đổi hệ thống eCB đã được chứng minh. các chiến lược trị liệu mới nhằm khôi phục chức năng hệ thống eCB bình thường [ 15 ].
Hiện tại, thuật ngữ ‘ cannabinoid ‘ dùng để chỉ hơn 100 terpenophenol có nguồn gốc từ Cannabis sativa [ 16 ] , cũng như các hợp chất tổng hợp tương tác trực tiếp hoặc gián tiếp với các thụ thể cannabinoid. Δ 9 -THC là thành phần tâm sinh lý nhất của Cannabis sativa thực vật , và các hoạt động sinh học của nó cũng như các hợp chất cannabinoid tổng hợp (hợp chất tổng hợp hoạt động trên thụ thể cannabinoid) chủ yếu qua trung gian thụ thể CB 1 và CB 2 . Cannabinoids được phân loại thành phytocannabinoids (được phân loại thành các loại khác nhau theo cấu trúc hóa học của chúng, chẳng hạn như9 -THC, Δ 8 -THC, cannabinol, CBD và cannabicyclol), các hợp chất tổng hợp hoạt động trên các thụ thể cannabinoid (tức JWH133, WIN55212-2, SR141716) và endocannabinoids (tức AEA và 2-AG) được sản xuất nội sinh ( Hình 1 ) .

Cấu trúc hóa học của Δ 9 -tetrahydrocannabinol ( 9 -THC), cannabidiol (CBD), anandamide (AEA) và WIN55212-2
Cannabinoids trong điều trị ung thư
Cannabinoids hiện đang được sử dụng ở những bệnh nhân ung thư để giảm nhẹ sự lãng phí, sự giả lập và nỗi đau thường đi kèm với bệnh ung thư. Một tiến bộ đáng kể trong việc sử dụng cannabinoid trong điều trị ung thư đến từ việc phát hiện ra một tiện ích tiềm năng của các hợp chất này để nhắm mục tiêu và tiêu diệt các tế bào ung thư. Năm 1975 Munson và cộng sự . [ 17 ] chứng minh rằng chính quyền của Δ 9 -THC, Δ 8 -THC và cannabinol ức chế sự tăng trưởng của tế bào ung thư tuyến Lewis phổi in vitro cũng như in vivo sau khi uống trongchuột. Sự quan tâm đến các đặc tính chống ung thư của cannabinoids thậm chí còn được đổi mới sau khi phát hiện ra hệ thống eCB và nhân bản của các thụ thể cannabinoid cụ thể. Kể từ đó, một số cannabinoids đã được chứng minh để phát huy tác dụng chống tăng sinh và pro-apoptosis trong các loại ung thư khác nhau (phổi, u thần kinh đệm, tuyến giáp, u lympho, da, lá lách, tử cung, vú, tuyến tiền liệt và ung thư biểu mô trực tràng) cả in vitro và in vivo [ 18 – 26 ]. Hơn nữa, các cơ chế chống ung thư khác của cannabinoids hiện đang xuất hiện, cho thấy khả năng can thiệp vào quá trình tân mạch khối u, di chuyển tế bào ung thư, bám dính, xâm lấn và di căn [ 27 ].
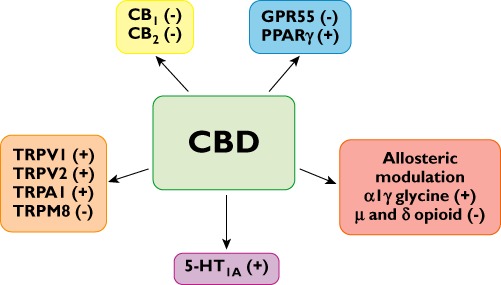
Tuy nhiên, việc sử dụng lâm sàng Δ 9 -THC và các chất chủ vận tổng hợp bổ sung thường bị hạn chế bởi tác dụng phụ tâm sinh lý không mong muốn của họ, và vì lý do này quan tâm đến phytocannabinoids không hoạt động, như CBD, đã tăng đáng kể trong những năm gần đây. Điều thú vị là CBD không có hoạt động hướng tâm thần và mặc dù nó có ái lực rất thấp đối với cả thụ thể CB 1 và CB 2 , gần đây nó đã được báo cáo là có tác dụng bất ngờ cao trong ống nghiệm khi là chất đối kháng của thụ thể CB 1 trong ống dẫn tinh của chuột [ 28 ] và não [ 29 ] mô. Ngoài ra, CBD hiển thị chủ nghĩa đảo ngược ở thụ thể CB 2 của con người [ 29]. Hơn nữa, các mục tiêu phân tử giả định khác của CBD là các thụ thể TRPV, 5-HT 1A , GPR55 và PPARγ (xem Hình 2 ). Bên cạnh tác dụng có lợi của nó trong điều trị đau và co cứng và các bệnh lý thần kinh trung ương khác, một số báo cáo đã chứng minh rằng CBD sở hữu tác dụng chống đông, prooptotic và ức chế di chuyển tế bào ung thư, bám dính và xâm lấn.

Một số mục tiêu sinh học tiềm năng của CBD
Tổng quan này sẽ tập trung vào các bằng chứng gần đây nhất liên quan đến hiệu quả của CBD trong điều chế u nguyên bào trong một số loại ung thư. Các dữ liệu có sẵn cho đến nay được tóm tắt trong Bảng 1 và được thảo luận chi tiết trong các đoạn sau.
Bảng 1
Tác dụng của cannabidiol đối với các loại ung thư khác nhau
NC = không được kiểm tra. Tăng; Giảm.
CBD và ung thư vú
Năm 2006, Ligresti và cộng sự . [ 30 ] lần đầu tiên chứng minh rằng CBD có khả năng ức chế và chọn lọc sự phát triển của các dòng tế bào khối u vú khác nhau (MCF7, MDA-MB-231), với I C 50 khoảng 6 6 m , và có hiệu lực thấp hơn đáng kể -các tế bào ung thư. Các chất chiết xuất giàu CBD và CBD (chứa khoảng 70% CBD cùng với lượng cannabinoids khác ít hơn) cũng ức chế sự phát triển của xenograft, thu được từ việc tiêm sc vào chuột thể thao của tế bào MDA-MB-231 ở người và giảm sự di căn của phổi. từ tiêm intrapaw của các tế bào ung thư biểu mô tuyến vú. Trong số các cơ chế tế bào và phân tử có thể có trong các hiệu ứng này, CBD dường như liên quan đến việc kích hoạt TRPV1 trực tiếp và / hoặc CB2 kích hoạt gián tiếp (thông qua FAAH), cũng như gây ra stress oxy hóa. Sau đó, nhóm của McAllister [ 31 ] đã chứng minh rằng, bên cạnh sự tăng sinh, CBD cũng can thiệp vào hai bước quan trọng khác của sự tiến triển tế bào ung thư vú, xâm lấn và di căn. Trong số ba nhóm hợp chất cannabinoid khác nhau được thử nghiệm (phytocannabinoids có ái lực với thụ thể CB 1 và CB 2 , phytocannabinoids không có ái lực đáng kể đối với thụ thể CB 1 và CB 2 và các hợp chất tổng hợp có ái lực với thụ thể CB 1 và CB 2 ), CBD đã được hiển thị là một trong những chất ức chế tăng sinh tế bào ung thư vú hiệu quả nhất ở người, được trang bị cho9 -THC và CP55940 trong sự ức chế, tương ứng, sự tăng trưởng tế bào MDA-MB-231 và MDA-MB-436, và là chất ức chế mạnh nhất của sự di chuyển tế bào MDA-MB-231. Điều thú vị là, CBD đã quy định sự biểu hiện của các gen quan trọng liên quan đến việc kiểm soát sự tăng sinh và xâm lấn của tế bào thông qua sự điều hòa của biểu hiện Id-1, một chất ức chế các yếu tố phiên mã helix-loop-helix cơ bản, có sự biểu hiện quá mức trong các tế bào ung thư vú. di cư và xâm lược. Do đó, khả năng CBD giảm đáng kể biểu hiện Id-1 trong các tế bào ung thư vú có liên quan đến hiệu quả của nó trong việc giảm sự xâm lấn của khối u.
Bốn năm sau , cùng một nhóm [ 32 ] đã chứng minh rằng tác động quan sát được của CBD đối với biểu hiện Id-1 đã qua trung gian bởi sự điều hòa của sự phosphoryl hóa kinase được điều hòa tín hiệu ngoại bào (pERK). Thật vậy, chất ức chế ERK , U0126 , đã hoàn nguyên một phần ức chế CBD gây ra sự tăng sinh và xâm lấn cũng như ảnh hưởng của nó đối với biểu hiện Id-1. Bên cạnh việc điều hòa ERK, việc sản xuất các loại oxy phản ứng (ROS) cũng được chứng minh là làm trung gian cho các tác động do CBD gây ra đối với sự tăng sinh tế bào và biểu hiện Id-1, do việc sử dụng máy quét ROS (tocopherol) đã đảo ngược các hiệu ứng CBD đã nói ở trên. Hơn nữa, các tác giả này đã chứng minh rằng CBD có hiệu quả trong việc giảm khối u nguyên phát và kích thước cũng như số lượng ổ di cănin vivo .
Cuối cùng , bài báo xuất sắc của Shrivastava et al . [ 33 ] thêm ánh sáng mới vào cơ chế tế bào thông qua đó CBD gây chết tế bào trong các tế bào ung thư vú. Các tác giả này cho thấy CBD gây ra cái chết tế bào phụ thuộc nồng độ của cả tế bào ung thư vú âm tính với thụ thể estrogen dương tính và thụ thể estrogen với cơ chế độc lập với CB 1 , CB 2và kích hoạt thụ thể TRPV1. Điều thú vị là, nồng độ CBD hiệu quả trong các tế bào khối u ít ảnh hưởng đến các tế bào động vật có vú, không gây u. Hơn nữa, kính hiển vi điện tử cho thấy hình thái phù hợp với sự cùng tồn tại của autophagy và apoptosis, những sự kiện này được thúc đẩy bằng cách gây ra căng thẳng lưới nội chất (ER) và ức chế tín hiệu Akt / mTOR / 4EBP1. Ngoài ra, sự gia tăng do CBD thúc đẩy trong sản xuất ROS là cơ bản để gây ra cả apoptosis và autophagy. Nghiên cứu sâu hơn về cơ chế tế bào liên quan đến cái chết của tế bào do CBD gây ra, họ phát hiện ra rằng CBD làm giảm tiềm năng màng ty thể, kích hoạt sự chuyển dịch protein tương tác Beclin2 (thầu) sang ty thể và giải phóng cytochrom C cho cytosol và cuối cùng là giải phóng cytochrom C kích hoạt con đường apoptotic nội tại.
Cuối cùng, mối quan hệ giữa apoptosis gây ra bởi CBD và cái chết của tế bào autophagic đã được khám phá bằng cách ngăn chặn từng dạng chết của tế bào bằng các chất ức chế cụ thể. Ức chế Caspase làm giảm apoptosis gây ra CBD và biểu hiện của các dấu hiệu protein trong các tế bào ung thư vú, trong khi đó ức chế apoptosis tăng cường tự phát như một cơ chế bù / thay thế của cái chết tế bào. Tỷ lệ apoptosis: autophagy trong cái chết tế bào do CBD dường như được trung gian thông qua Beclin1, một phân tử tín hiệu quan trọng trong quá trình autophagic. Điều trị CBD gây ra sự phân cắt của Beclin1 và sự chuyển vị tiếp theo của sản phẩm phân tách thành ty thể, nơi nó có thể gây ra apoptosis thông qua việc tăng cường giải phóng cytochrom C [ 34 , 35 ].
Nhìn chung, công trình này nhấn mạnh sự hiện diện của sự cân bằng phức tạp giữa apoptosis qua trung gian autophagy và ty thể trong cái chết tế bào ung thư vú do CBD gây ra và củng cố ý tưởng rằng CBD có thể được coi là một tác nhân thay thế cho liệu pháp ung thư vú. Hình 3 cho thấy một biểu đồ sơ đồ của các con đường truyền tín hiệu liên quan đến tác động của CBD trong sự tăng sinh và xâm lấn tế bào ung thư vú.

Sơ đồ biểu diễn các đường dẫn tín hiệu liên quan đến tác động của CBD đối với ung thư vú
CBD và u thần kinh đệm
CBD cũng sở hữu các đặc tính chống u trong u thần kinh đệm, khối u có nguồn gốc thần kinh đệm đặc trưng bởi sự không đồng nhất về hình thái và di truyền và được coi là một trong những khối u tàn phá nhất, cho thấy tốc độ tăng sinh cao, xâm lấn mạnh mẽ và không nhạy cảm với hóa trị.
Sau bài báo bán nguyệt của Jacobsson et al . [ 36 ] chứng minh tác dụng phụ thuộc huyết thanh của CBD khi tăng sinh tế bào thần kinh đệm C6, Massi et al . vào năm 2004 [ 37 ] đã báo cáo rằng CBD có hiệu quả trong việc ức chế sự tăng sinh tế bào thần kinh đệm của con người U87-MG và U373 trong ống nghiệm thông qua việc gây ra apoptosis. Thật thú vị, CBD không ảnh hưởng đến khả năng tồn tại của các tế bào thần kinh đệm chính không biến đổi [ 38 ]. Khi xenograft khối u được tạo ra ở những con chuột bị suy giảm miễn dịch, điều trị trong cơ thể bằng vivo với CBD làm giảm đáng kể sự phát triển khối u [ 37 ].
Tác dụng chống tăng sinh của CBD là độc lập với thụ thể cannabinoid và vanilloid. Chất đối kháng thụ thể CB 2 SR144528 hoàn nguyên tác dụng của CBD, nhưng theo cách yếu và thoáng qua [ 37 ]. Quan trọng hơn, bài báo này lần đầu tiên chứng minh rằng tác dụng chống khối u của CBD liên quan đến việc gây ra stress oxy hóa, thông qua việc tăng sản xuất sớm của ROS, làm cạn kiệt glutathione nội bào và tăng hoạt động enzyme liên quan đến GSH. Theo đó, tác dụng chống tăng sinh của CBD đã bị đảo ngược bởi chất chống oxy hóa , tocopherol. Điều quan trọng, CBD đã không tạo ra sản xuất ROS trong các tế bào thần kinh đệm chính không biến đổi [ 38 ].
Trong số các sự kiện tế bào liên quan đến cái chết của tế bào u thần kinh đệm, CBD đã tạo ra một bản phát hành phụ thuộc thời gian của cytochrom C và kích hoạt caspase-8, −9 và −3, cho thấy sự liên quan của cả con đường apoptotic bên trong và bên ngoài [ 38 ]. Marcu và cộng sự . [ 39 ] sau đó đã xác nhận hiệu quả của CBD trong việc ức chế sự phát triển của nhiều dòng tế bào glioblastoma theo cách mạnh hơn Δ 9 -THC. Điều thú vị là , điều trị kết hợp Δ 9 -THC với CBD đã chứng minh rằng CBD đã tăng cường hiệu quả ức chế Δ 9 -THC đối với sự phát triển của tế bào glioblastoma, nhưng không xâm lấn [ 39 ]. Để phù hợp với điều này, gần đây Torres et al . [40 ] xác nhận rằng điều trị kết hợp với CBD và Δ 9 -THC làm giảm đáng kể khả năng sống sót của tế bào thần kinh đệm ở người giúp tăng cường cả tự kỷ và apoptosis và kích hoạt caspase-3. Hơn nữa, việc sử dụng kết hợp liều CBD dưới mức tối ưu và Δ 9 -THC đã làm giảm sự phát triển của xenograft khối u có nguồn gốc tế bào U87 ở chuột nude ở mức độ lớn hơn so với điều trị bằng các hợp chất riêng lẻ, cho thấy việc sử dụng liệu pháp phối hợp tiềm năng sẽ làm giảm số lượng tâm sinh lý Δ 9 -THC.
Hiệu quả hiệp đồng của liệu pháp kết hợp ngụ ý bắt giữ chu kỳ tế bào in vitro , cảm ứng ROS và apoptosis thông qua kích hoạt bền vững caspase-3, −7 và −9, cũng như điều chế cụ thể của kinase được điều hòa tín hiệu ngoại bào, ERK [ 39 ]. Những tác dụng này đã không được quan sát với từng hợp chất riêng lẻ, cho thấy chúng là một đặc quyền của điều trị kết hợp. Khác với dữ liệu Marcu của [ 39 ], kết quả gần đây của chúng tôi (TS Valenti, Đại học Insubria, Varese, pers comm..) [ 41 ] cho thấy, cả U87-MG và Δ 9 -THC chống tế bào u thần kinh đệm T98G nhân dòng, CBD mỗi seđiều chỉnh giảm mạnh hai phân tử tín hiệu quan trọng trong sự tăng sinh tế bào khối u, ERK và PI3K / Akt. Ngoài ra, nó còn ức chế yếu tố phiên mã gây thiếu oxy HIF-1α, một trong những yếu tố kích thích quan trọng nhất đối với sự sống của tế bào, sự vận động và sự hình thành khối u. Do đó, sự ức chế của ba phân tử này xuất hiện như là một phần của nhiều mục tiêu phân tử cho hoạt động chống tân sinh của CBD [ 41 ].
Phân tích sinh hóa sâu hơn về các mô khối u u thần kinh đệm được tách ra từ chuột nude được điều trị in vivo với CBD cho thấy sự giảm đáng kể hoạt động và hàm lượng 5-LOX, cũng như sự kích thích rõ rệt của FAAH và giảm hàm lượng AEA [ 42 ].
Bên cạnh sự phát triển của tế bào, CBD làm giảm sự di chuyển tế bào u thần kinh đệm [ 43 ] và sự xâm lấn trong xét nghiệm buồng Boyden [ 39 ], ở nồng độ thấp hơn mức cần thiết để ức chế sự tăng sinh tế bào. Tác dụng chống di chuyển của CBD không được đối kháng bởi các chất đối kháng thụ thể cannabinoid chọn lọc hoặc bằng tiền xử lý với độc tố ho gà, cho thấy không có sự tham gia của các thụ thể cannabinoid cổ điển và / hoặc các thụ thể kết hợp protein G i / o .
CBD dường như chống lại sự tăng sinh tế bào glioma và xâm lấn thông qua nhiều cơ chế, như được tóm tắt trong Hình 4 .

Sơ đồ biểu diễn các đường dẫn tín hiệu liên quan đến hiệu ứng CBD trên u thần kinh đệm
CBD và bệnh bạch cầu / ung thư hạch
Gallily et al . [ 44 ] cung cấp bằng chứng đầu tiên về khả năng khai thác CBD trong điều trị các bệnh lymphoblastic. Họ đã chứng minh rằng điều trị CBD gây ra apoptosis, thông qua hoạt hóa caspase-3 trong dòng tế bào ung thư bạch cầu tủy cấp tính ở người, trong khi nó không có tác dụng đối với bạch cầu đơn nhân của người từ người bình thường.
Sau đó, McKallip et al . [ 45 ], bằng cách sử dụng dòng tế bào lympho EL-4 ở chuột và dòng tế bào ung thư bạch cầu Jurkat và Molt-4 ở người, đã chứng minh rằng phơi nhiễm CBD dẫn đến giảm đáng kể qua trung gian thụ thể CB 2 về số lượng tế bào khả thi cũng như cảm ứng apoptosis, cả in vitro và in vivo .
Trong các tế bào Jurkat, phơi nhiễm CBD dẫn đến việc kích hoạt caspase-8, -9 và -3, sự phân cắt của polymerase poly (ADPribose) và giảm giá thầu toàn thời gian, cho thấy khả năng trao đổi chéo giữa bên trong và bên ngoài con đường apoptotic. Hơn nữa, việc tiếp xúc với CBD dẫn đến mất tiềm năng màng ty thể và giải phóng cytochrom C. Sau đó, như trong các tế bào khối u khác, apoptosis gây ra bởi CBD đòi hỏi phải tăng sản xuất ROS. Cuối cùng, CBD đã làm giảm nồng độ protein kinase được hoạt hóa bằng phospho-p38 [ 45 ], và hiệu ứng này đã bị chặn bằng cách xử lý với chất đối kháng chọn lọc CB 2 hoặc chất tẩy trắng ROS. Ngoài ra, điều trị CBD làm giảm đáng kể gánh nặng khối u và tăng mức độ khối u apoptotic ở chuột mang EL-4 [ 45].
Cùng với nhau, kết quả cho thấy CBD, hoạt động thông qua thụ thể CB 2 và sản xuất ROS, có thể đại diện cho một phương pháp điều trị mới và có tính chọn lọc cao đối với bệnh bạch cầu. Hơn nữa, bằng chứng trước chỉ ra rằng bệnh bạch cầu nhân lực và u lympho thể hiện mức độ cao hơn đáng kể của CB 2 thụ so với dòng tế bào ung thư khác, cho thấy rằng các khối u có nguồn gốc miễn dịch có thể rất nhạy cảm với các CB 2 hiệu ứng qua trung gian của CBD [ 46 ].
CBD và ung thư phổi
Do phản ứng kém của ung thư phổi với liệu pháp sẵn có và bản chất sinh học tích cực của nó, một loạt các mục tiêu và chiến lược điều trị mới cho việc điều trị của họ hiện đang được nghiên cứu [ 47 – 50 ].
Gần đây, Ramer và cộng sự . [ 51 – 53 ] đã nghiên cứu ảnh hưởng của CBD đến các đặc tính xâm lấn của các tế bào A549, một dòng tế bào ung thư biểu mô phổi ở người biểu hiện cả CB 1 và CB 2 , cũng như các thụ thể TRPV1. Sử dụng các thử nghiệm xâm lược Matrigel , họ đã tìm thấy một cuộc xâm lược bị suy yếu do CBD điều khiển bởi các tế bào A549 bị đảo ngược bởi các thụ thể CB 1 và CB 2 cũng như các chất đối kháng TRPV1.
Điều trị CBD đồng thời điều chỉnh tăng chất ức chế mô của ma trận metallicoproteinase-1 (TIMP-1) và giảm khả năng xâm lấn tế bào khối u của CBD đã được đảo ngược bằng cách hạ thấp biểu hiện TIMP-1 thông qua cách tiếp cận siRNA. Những kết quả này cho thấy mối liên hệ nhân quả giữa việc tái cấu trúc TIMP-1 và hành động chống xâm lấn CBD. CBD cũng được chứng minh là gây ra sự phosphoryl hóa p38 và ERK như các cơ chế ngược dòng cho cảm ứng TIMP-1 và giảm khả năng xâm lấn sau đó. Điều thú vị là tất cả các sự kiện tế bào này đã bị chặn bởi các chất đối kháng thụ thể cannabinoids hoặc TRPV1.
Sự ức chế đáng kể sự xâm lấn tế bào A549 sau điều trị CBD cũng đi kèm với sự điều hòa của một yếu tố quan trọng khác liên quan đến sự điều hòa của tế bào, chất ức chế hoạt hóa plasminogen PAI-1 [ 52 ]. CB 1 và CB 2 cũng như các chất đối kháng thụ thể TRPV1 đã ngăn chặn tác dụng quan sát được của CBD đối với sự tiết PAI-1 và xâm lấn tế bào. Tương ứng tái tổ hợp PAI-1 và PAI-1 siRNA của con người dẫn đến sự điều chỉnh tăng và giảm phụ thuộc vào nồng độ, tương ứng, cho thấy vai trò quan trọng của PAI-1 trong xâm lấn A549.
Ngoài ra , các nghiên cứu in vivo trên chuột nude aymastic thymic cho thấy sự ức chế đáng kể di căn phổi A549 sau khi điều trị CBD [ 51 ] và sự điều hòa giảm đáng kể protein PAI-1 đã được chứng minh trong xenograft của chuột được điều trị CBD [ 52 ].
Điều đáng chú ý là CBD giảm xâm lấn trong một loạt các nồng độ trị liệu có liên quan (0,01-0,05 μ m ), kể từ khi nồng độ đỉnh trong huyết tương của CBD ở người tình nguyện khỏe mạnh sau khi chính quyền của Sativex ™ (1: 1 tỷ lệ Δ 9 -THC và CBD ) được báo cáo là từ 0,01 m m đến 0,05 m m [ 54 ].
Cùng với nhau, những phát hiện này cung cấp một cơ chế mới dựa trên hành động chống xâm lấn của CBD đối với các tế bào ung thư phổi ở người và ngụ ý sử dụng nó như một lựa chọn điều trị trong điều trị ung thư xâm lấn cao.
CBD và khối u nội tiết
Ung thư tuyến giáp là bệnh ác tính nội tiết phổ biến nhất và Ligresti et al . [ 30 ] đã chứng minh rằng CBD gây ra tác dụng chống tăng sinh đối với các tế bào KiMol của tuyến giáp chuột, được biến đổi bằng vc-ras oncogene. Tác dụng này của CBD được liên kết với một khối chu kỳ tế bào khi chuyển pha G1 / S, cũng như gây ra apoptosis.
Sau đó, Lee và cộng sự . [ 55 ] đã chứng minh rằng CBD gây ra apoptosis rõ rệt ở cả tế bào tuyến ức và tế bào tuyến ức EL-4, với apoptosis qua trung gian CBD xảy ra sớm hơn trong các tế bào EL-4 so với tế bào tuyến ức. Các sự kiện di động được kích hoạt bởi CBD là tương tự trong cả hai tế bào T, thế hệ ROS đóng vai trò then chốt. Sự hiện diện của N-acetyl-L-cysteine (NAC), tiền chất của glutathione, làm giảm rõ rệt việc gây ra apoptosis và phục hồi mức độ giảm của thiol tế bào.
Quan sát rằng CBD gây ra stress oxy hóa ở tuyến ức, tế bào EL-4 và tế bào lách [ 56 ] chứng minh quan niệm rằng, không giống như bạch cầu đơn nhân, cả tế bào T cả nguyên sinh và bất tử, đều nhạy cảm và phản ứng tương tự như CBD, với vai trò trung tâm của thế hệ ROS .
CBD và ung thư ruột kết
Ung thư ruột già là nguyên nhân chính gây bệnh tật và tử vong ở các nước phương Tây. Một bài báo gần đây của nhóm Izzo [ 57 ] đã chứng minh tác dụng hóa trị của CBD trong mô hình động vật tiền lâm sàng của bệnh ung thư ruột kết dựa trên chính quyền azoxymethane (AOM) ở chuột. Điều trị AOM có liên quan đến sự tập trung vào mật mã (ACF), sự hình thành khối u và khối u, cũng như sự điều hòa của phospho-Akt, iNOS và COX-2 và sự điều hòa của caspase-3. CBD có hiệu quả trong việc làm giảm ACF, polyp và khối u và chống lại sự thay đổi phospho-Akt và caspase-3 do AOM gây ra. Nghiên cứu in vitro , hỗ trợ hiệu quả có lợi của CBD. Thật vậy, trong các dòng tế bào ung thư đại trực tràng, CBD bảo vệ DNA khỏi tổn thương oxy hóa, tăng nồng độ endocannabinoid và giảm sự tăng sinh tế bào trong CBCách nhạy cảm đối kháng 1 -, TRPV1- và PPARγ.
Theo các hồ sơ an toàn của nó, những kết quả này cho thấy rằng CBD có thể xứng đáng được xem xét lâm sàng trong phòng ngừa ung thư ruột kết.
CBD và sự hình thành mạch
Angiogenesis bao gồm sự hình thành các mạch máu mới từ những người đã có từ trước và đại diện cho một mục tiêu điều trị đầy hứa hẹn khác cho liệu pháp ung thư. Nói chung , cannabinoids đã được chứng minh là hoạt động như các yếu tố chống tạo mạch bằng cách loại bỏ các tế bào khối u để giảm sản xuất các yếu tố pro-angiogen và / hoặc điều chỉnh trực tiếp các tế bào nội mô [ 27 ].
Đáng ngạc nhiên, cho đến nay không có nghiên cứu đã điều tra ảnh hưởng của CBD đối với sự hình thành mạch. Dữ liệu của chúng tôi hiện đang chờ xuất bản [ 58 ] đã chứng minh rằng CBD có khả năng ức chế tăng sinh tế bào HUVE, di cư và xâm lấn thông qua việc gây ra tế bào tế bào nội mô mà không gây ra apoptosis. Điều thú vị là, CBD cũng ảnh hưởng đến sự biệt hóa tế bào nội mô thành mao mạch hình ống cũng như sự phát triển của các cấu trúc giống như mao mạch từ các nhân vật siêu nhân HUVEC trong ống nghiệm . Ngoài ra, các đặc tính chống tạo mạch của CBD cũng được thể hiện trên in vivo , sử dụng mô hình bọt biển matrigel. Những hiệu ứng này có liên quan đến điều chế giảm một số phân tử liên quan đến sự hình thành mạch, bao gồm MMP2, MMP9, uPA, endothelin-1, PDGF-AA và CXCL16.
Nói chung , các dữ liệu sơ bộ này chứng minh rằng, bên cạnh các hành động chống tăng sinh và chống xâm lấn nổi tiếng, CBD cũng có thể phát huy tác dụng chống angiogen, do đó tăng cường hơn nữa ứng dụng tiềm năng của nó trong điều trị ung thư.
Kết luận và định hướng trong tương lai
Nói chung, CBD cannabinoid có nguồn gốc từ thực vật không hoạt động thể hiện các hoạt động chống apoptotic và chống tăng sinh trong các loại khối u khác nhau và cũng có thể gây ra các đặc tính chống di cư, chống xâm lấn, chống di căn và có lẽ chống di căn. Trên cơ sở những kết quả này, bằng chứng đang nổi lên cho thấy CBD là chất ức chế mạnh cả sự phát triển và lây lan của ung thư.
Điều thú vị , tác dụng chống ung thư của hợp chất này có vẻ là lựa chọn cho các tế bào ung thư, ít nhất là trong ống nghiệm, vì nó không ảnh hưởng đến các dòng tế bào bình thường. Hiệu quả của CBD được liên kết với khả năng nhắm mục tiêu vào nhiều con đường tế bào kiểm soát sự phát sinh khối u thông qua việc điều chế tín hiệu nội bào khác nhau tùy thuộc vào loại ung thư được xem xét. Tác động phổ biến nhất của CBD là sự gia tăng sản xuất ROS dường như là yếu tố quyết định để kích hoạt hành động có lợi của nó trong tất cả các loại tế bào ung thư được coi là. Vai trò của thụ thể cannabinoid / vanilloid trong việc làm trung gian tác dụng CBD còn gây tranh cãi hơn. Trong một số trường hợp (phổi, bệnh bạch cầu, đại tràng), sự đóng góp rõ ràng của các thụ thể này đã được chứng minh thông qua việc sử dụng các chất đối kháng cụ thể, nhưng trong các loại ung thư khác (glioma và vú) sự liên quan của chúng chỉ xuất hiện bên lề hoặc không có. Ngoài ống nghiệmdữ liệu, hiệu quả của CBD trong việc giảm sự phát triển của khối u và, trong một số trường hợp, sự di căn đã được xác nhận trong các mô hình động vật thí nghiệm. Tuy nhiên, ứng dụng lâm sàng tiềm năng của CBD trong điều trị ung thư cần được xem xét. Độc tính thấp của nó chắc chắn là một điểm khởi đầu tốt. CBD hoạt động như một hợp chất không độc hại; thực sự uống CBD 700 mg mỗi ngày −1 trong 6 tuần không cho thấy bất kỳ độc tính quá mức nào ở người [ 59 ] cho thấy khả năng khai thác của nó để điều trị kéo dài. Con đường quản trị xuất hiện nhiều vấn đề hơn vì sự hấp thu qua đường miệng của CBD chậm và không thể đoán trước. Tuy nhiên, 6 tuần điều trị CBD bằng miệng 10 mg kg −1 ngày 1 đã kích thích nồng độ trung bình của CBD trong huyết tương từ 6 đến 11ng ml 1(khoảng 0,036 m m ) [ 60 ] không khác biệt đáng kể trong 6 tuần quản trị. Thật thú vị, phạm vi nồng độ này đã được chứng minh là hoạt động trong việc ức chế sự xâm lấn tế bào ung thư phổi [ 52 , 53 ], do đó cho thấy rằng trong một số trường hợp, đường uống có thể là lựa chọn thích hợp. Ngoài ra, dữ liệu thực nghiệm cho thấy điều trị kết hợp với CBD và Δ 9 -THC có thể hiệu quả hơn trong việc giảm sự tăng sinh tế bào ung thư, cho thấy rằng đồng quản trị có thể là lựa chọn tốt hơn cho điều trị ung thư. Theo đó, điều trị bằng oromucosal với Sativex ™ 10 mg (một công thức với tỷ lệ 1: 1 của CBD và Δ 9-THC, gần đây đã được phê duyệt cho bệnh đa xơ cứng) dẫn đến nồng độ CBD trong huyết tương có hiệu quả trong việc giảm sự xâm lấn tế bào phổi trong ống nghiệm . Do đó, kết quả thu được với Sativex ™ cho thấy rằng việc sử dụng các hiệp hội khác nhau của phytocannabinoids theo tỷ lệ thay đổi có thể dẫn đến kết quả tốt hơn nếu không có tương tác dược động học [ 61]. Hơn nữa, chính quyền oromucosal có thể là một lựa chọn đầu tiên trong trường hợp buồn nôn và ói mửa. Cuối cùng, việc sử dụng CBD / Sativex có thể được đề xuất kết hợp với các tác nhân hóa trị liệu cổ điển để kiểm tra sự hiện diện của tác dụng hiệp đồng có khả năng cho phép giảm liều hóa trị lâm sàng, do đó giảm độc tính trong khi vẫn duy trì hiệu quả. Theo hồ sơ an toàn và xem xét rằng CBD hiện đang được sử dụng ở những bệnh nhân mắc bệnh đa xơ cứng, những phát hiện ở đây tóm tắt cho thấy rằng CBD có thể xứng đáng được xem xét lâm sàng trong điều trị ung thư.