Cơ chế bám dính ACE2 của virus corona và cách hạn chế chúng
Tìm hiểu cơ chế xâm nhập tế bào của virus corona để tiêu diệt chúng
Gần đây WHO có khuyến cáo rằng các loại Vaccine covid19 hiện nay không phải à cách dể chấm dứt đại dịch. Cần một loại vaccine đặc hiệu hơn cho từng chủng hoặc thuốc có thể không chế Covid19 khi xuất hiện nhiều biến chủng mới khó lường hơn. Các biến chủng liên tiếp đột biến và tiếp tục lây lan với cả những bệnh nhân Covid19 đã khỏi hay nhưng người đã tiêm đủ 2,3 mũi vaccine. Chuyên gia y tế người Israel cũng đã bình luận sau khi nước ông đã tiêm đủ 4 mũi chủ yếu là Vaccine công nghệ mRNA là Pfizer và Mordena thì việc tiếp tục tiếp mũi nhắc lại cứ sau 4 tháng không phải là cách để chấm dứt đại dịch. Ngay sau đó nước này cũng đặt mua 5 triệu liều Vaccine Nonavax của Mỹ và dự kiến đặt tiếp 5 triệu liều bổ sung cho nhưng ai muốn tiêm nhắc lại mũi thứ 5 mà không muốn tiếp tục tiêm mRNA vaccine. Chuyên gia về Vaccine của Astra Zeneca cũng cho rằng tiêm quá 2 mui trong một năm không phải cách mà vaccine covid nên hoạt động và nước này cũng không tiêm vaccine cho trẻ từ 5 tới 11 tuổi. Các vaccine ở Mỹ cho trẻ dưới 5 tuổi cũng không được FDA thông qua thì tính hiệu quả thấp của nó, chỉ đạt 20%.
Rõ ràng đại dịch vẫn chưa kết thúc với cả những nước đã tiêm đủ 4 mũi như Israel hay các nước như Châu Âu và Nhật Bản. Đại dịch vẫn tiếp tục kho lường khi có thêm biến chủng Omicon a1 , B2 … có biến chứng nặng hơn Delta và lây lan ở nhóm độ tuổi trẻ hơn.
Câu hỏi đặt ra là cơ chế nào khiến cho Vaccine trở nên kém hiệu quả cứ sau 4-6 tháng? Tế bào T-cell không có khả năng ghi nhớ miễn dịch kéo dài như các loại Vaccine thông thường của các bệnh khác trước đây?
Tại sao trẻ em lại có triệu chứng nhẹ hơn người trưởng thành? Chúng ta có bỏ qua cơ hội nghiên cứu thuốc nào không?
Các vaccine sử dụng công nghệ nào cũng đều giảm tác dụng và không chặn được biến chủng tiếp theo và chúng ta sẽ phải tiêm bao nhiêu liều nhắc lại, bao nhiêu loại vaccine cho tới khi kết thúc dịch? Tác hại của việc tiêm quá nhiều vaccine lên hệ miễn dịch tự thân như thế nào?
===================
Cấu trúc virus SARS-CoV-2
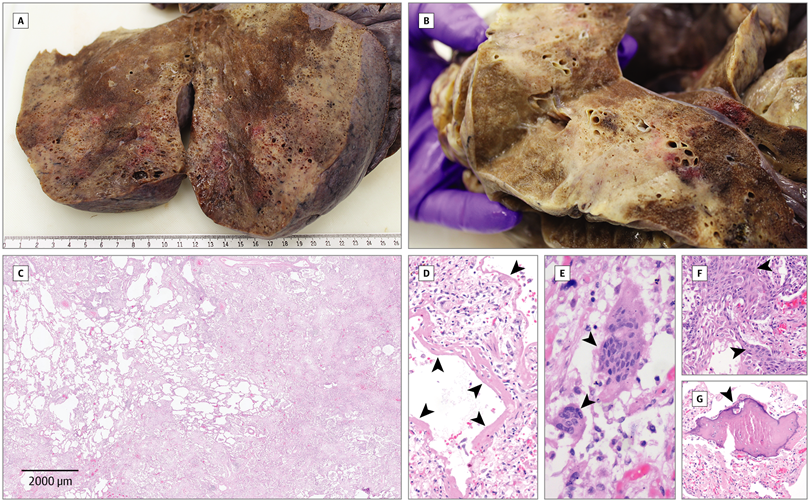
SARS-CoV-2 được viết tắt từ Severe Acute Respiratory Syndrome Coronavirus 2 (Coronavirus gây ra hội chứng suy hô hấp cấp) , là một chủng virus thuộc họ Coronaviridae, gây ra Hội chứng suy hô hấp cấp ở người. Virus này gây ra đại dịch từ cuối tháng 12 năm 2019 nên còn được tổ chức Y tế thế giới (WHO – World Health Organization) gọi là COVID-19. Cấu trúc virion của Coronavirus là dạng virus có vỏ bao, cấu trúc hình cầu với đường kính 65 – 125nm, mang vật chất di truyền có bản chất RNA (RiboNucleic Acid) mạch dương (+ssRNA – positive single – strand RNA) có kích thước 30kb. Bộ gene của SARS-CoV-2 mã hoá cho ba protein cấu trúc chính, gồm: protein S (spike protein), protein M (Membrane protein) và protein E (Envelop protein). Protein M có vai trò quyết định hình dạng virion của virus (hình 1). Và protein E đóng vai trò thiết yếu kiểm soát quá trình đóng gói cấu trúc virion của virus trong quá trình tăng sinh virus bên trong tế bào vật chủ. Protein S là protein xuyên màng nhô ra phía ngoài bề mặt cấu trúc virion của virus, gồm tiểu phần S1 quyết định khả năng bám virus vào thụ thể của tế bào vật chủ và tiểu phần S2 quyết định khả năng hoà nhập giữa virion virus và màng tế bào chủ trong quá trình xâm nhiễm [4]. Dựa vào protein S, chúng ta có thể xác định được biến chủng của virus vì các đột biến ở virus chủ yếu xảy ra ở protein này.
.png)
Cơ chế xâm nhập của virus SARS-COV-2
Protein S của SARS-CoV-2 có ái lực rất cao với thụ thể ACE2 (Angiotensin-Converting enzyme 2) trên tế bào vật chủ [5], là thụ thể chức năng trên các tế bào biểu mô type 2 thuộc phế nang và là thụ thể duy nhất virus có thể bám vào để bắt đầu quá trình xâm nhiễm. Sau khi virus bám lên thụ thể thành công, virus cần sự có mặt của protease TMPRSS2 (Transmembrane protease serine 2) trên tế bào vật chủ để có thể phân cắt protein S, cho phép quá trình hoà nhập màng virion và tế bào vật chủ diễn ra (hình 2). Như vậy, có thể nói trên cơ thể vật chủ, tế bào đồng biểu hiện hai protein ACE2 và TMPRSS2 đều trở thành tế bào đích, thuận lợi cho sự xâm nhiễm của virus [6]. Ngoài ra, marker bề mặt CD147 ở tế bào vật chủ cũng được cho rằng có vai trò hỗ trợ quá trình xâm nhiễm của SARS-CoV-2. Sau khi hoà nhập màng tế bào chủ, virus sẽ phóng thích RNA vào tế bào chất của tế bào chủ, và tiến hành các cơ chế vừa nhân bản vừa dịch mã sợi RNA virus để tăng sinh số lượng virus bên trong tế bào chủ. Sau khi các protein S, protein M, protein E được biểu hiện hoàn tất, quá trình đóng gói tạo thành virus mới sẽ diễn ra. Các virus mới sẽ được di chuyển đến màng tế bào và phóng thích ra môi trường xung quanh và tiếp tục các chu kì xâm nhiễm mới.
Thụ thể ACE2 và protease TMPRSS2 đồng biểu hiện ở đa số các tế bào thuộc hệ hô hấp của người. Một nghiên cứu cho thấy mức độ biểu hiện của hai protein này ở trẻ em thấp hơn đáng kể so với người trưởng thành, và mức độ biểu hiện này tăng cao đáng kể ở những người có tiền sử tiếp xúc với thuốc lá và những người mắc bệnh lý phổi tắc nghẽn mãn tính (COPD – Chronic obstructive pulmonary disease). Nghiên cứu của Zou X. và cộng sự phân tích mức độ biểu hiện thụ thể ACE2 cho thấy thụ thể này biểu hiện trên nhiều loại tế bào khác nhau: 7,5% tế bào cơ tim biểu hiện thụ thể ACE2; tỉ lệ này ở tế bào hồi tràng là 30%, ở tế bào thận là 4%, tế bào cơ bàng quang là 2,4% và chỉ khoảng 2% ở các tế bào thuộc hệ hô hấp. Nghiên cứu này cũng chỉ ra rằng, mô và cơ quan đích chỉ cần có trên 1% tế bào biểu hiện thụ thể này đều có thể là mục tiêu xâm nhiễm của SARS-CoV-2 [7] .
.jpg)
Hình 2: Cơ chế xâm nhiễm và tăng sinh của SARS-CoV-2. SARS-CoV-2 nhận diện thụ thể ACE2 trên bề mặt tế bào chủ, và/hoặc nhờ vào sự biểu hiện của protease TMPRSS2 hỗ trợ cho sự xâm nhiễm của virus vào tế bào chất của tế bào chủ. Tại đây, SARS-CoV-2 nhân bản RNA và biểu hiện các protein cần thiết cho sự tăng sinh số lượng virus. Sau đó đóng gói tạo ra các virion mới và tiết ra môi trường xung quanh qua cơ chế xuất bào
 |
26.12.2021 10:13 |
Ngoài biểu hiện chính ở đường hô hấp, biểu hiện lâm sàng tiêu hóa cũng là vấn đề thường gặp ở bệnh nhân COVID-19, nhưng chưa được quan tâm đúng mức.
SARS-CoV-2 xâm nhập đường tiêu hóa bằng cách nào?
Khi các hạt virus SARS-CoV-2 xâm nhập vào niêm mạc mũi hoặc miệng, thì một loại protein có tên gọi là “spike protein” trên bề mặt virus sẽ gắn kết với một thụ thể men chuyển tên là angiotensin 2 (ACE2).
ACE2 là thụ thể tồn tại ở khắp nơi trong cơ thể, chính vì thế, khi virus xâm nhập, nó sẽ biến các tế bào thành một “nhà máy”, tạo ra hàng triệu bản sao của chính nó và gây ra bệnh COVID-19. Sau đó SARS-CoV-2 có thể đi theo đường thở ra hoặc các giọt bắn do ho ra để lây nhiễm cho người khác.
BSCK2. Trần Kiều Miên – Phó Chủ tịch hội khoa học tiêu hóa Việt Nam cho biết, SARS-CoV-2 bám vào và tấn công các tế bào thông qua hệ thống men chuyển ACE2. Virus tấn công vào đa phủ tạng và gắn kết với angiotensin 2 và phân bố rộng rãi gần như trên toàn bộ cơ thể. Như vậy các hệ thống trong cơ thể đều có xuất hiện angiotensin 2 và virus đều có thể bám dính cơ quan đó.
Về cơ chế rối loạn ảnh hưởng đến đường tiêu hóa, từ khi bệnh nhân hít phải giọt bắn có SARS-CoV-2, virus sẽ đi vào cơ thể bằng 2 con đường:
Thứ nhất là đi vào phổi qua đường hô hấp và biểu hiện bệnh COVID-19 ở phổi. Bệnh nhân thường tử vong với các bệnh lý ở phổi và viêm phổi đông đặc.
Thứ hai là đi theo con đường tiêu hóa bằng cách các gai của virus gắn vào các tế bào của hệ thống ACE2. Mà các thụ thể men chuyển ACE2 có rất nhiều trên hệ tiêu hóa, từ gan mật, đến đường tiêu hóa ống.
Ảnh hưởng nghiêm trọng của COVID-19 đến đường tiêu hóa
Men ACE2 có mặt tại hầu hết các cơ quan trong cơ thể người. Trên hệ hô hấp, men ACE2 biểu hiện chủ yếu trên bề mặt các tế bào phổi, số ít hơn trên biểu mô niêm mạc miệng, mũi và vòm họng. Ngoài ra, ACE2 còn được tìm thấy khá nhiều tại tế bào cơ tim, ống lượn gần của thận, biểu mô bàng quang, và các tế bào ruột non, nhất là hồi tràng. Virus sau khi bị thực bào bởi đại thực bào sẽ có khả năng lan truyền từ phổi đến các cơ quan có biểu hiện men ACE2 với mật độ cao thông qua hệ thống tuần hoàn.
BSCK2. Trần Kiều Miên cho biết: Tại hệ tiêu hóa, ACE2 là một chất điều hòa quan trọng trong cơ thể. Nó mang tính chất độc lập và có chức năng ổn định acid amin ở trong thức ăn, kiểm soát sự hấp thu natri cũng như các acid amin. Acid amin có 2 loại là cần thiết và không cần thiết. Trong cơ thể AEC2 sẽ kích thích và hấp thu acid amin cần thiết và quan trọng, chuyển hóa các chất quan trọng và là khởi đầu cho hệ thống miễn dịch của cơ thể.
Khi virus gắn kết ACE2 nó sẽ làm mất ACE2 khiến cơ thể giảm hấp thu các acid amin có lợi, những chất tạo ra hệ miễn dịch, từ đó làm giảm hàng rào kháng khuẩn của đường tiêu hóa, giảm yếu tố bảo vệ và giảm các vi khuẩn có lợi, dẫn đến loạn khuẩn đường tiêu hóa.
Theo ThS. Trần Đăng Khoa – Bộ môn Nội nhiễm – Đại học Y Dược TP.Hồ Chí Minh: Trong các nghiên cứu ghi nhận triệu chứng tiêu hóa ở bệnh nhân COVID-19 đang nhiễm và hậu nhiễm lên đến 79% và thường xuất hiện trước cả các biểu hiện hô hấp.
Các triệu chứng tiêu hóa được ghi nhận như:
Tiêu chảy
Chán ăn, ăn không ngon
Nôn và buồn nôn
Hội chứng ruột kích thích
Rối loạn vi khuẩn ở đường ruột…
COVID-19 ảnh hưởng đến hệ thống tiêu hóa, gây rối loạn bài tiết các men tiêu hóa, acid ở đường tiêu hóa, dẫn đến loét dạ dày. Nghiêm trọng hơn là biểu hiện xuất huyết tiêu hóa. Các triệu chứng này có thể xuất hiện ở tất cả các mức độ bệnh COVID-19 từ nhẹ, trung bình, nặng, thậm chí sau khi khỏi COVID-19 với các mức độ nghiêm trọng khác nhau. Tất cả những điều này đều dẫn đến hậu quả là làm giảm chất lượng sống của bệnh nhân.
Theo BSCK2. Trần Kiều Miên: “COVID-19 có thời gian triệu chứng từ khoảng 14 ngày. Thông thường triệu chứng lâm sàng nặng là từ 5-7 ngày. Sau khi xuất hiện triệu chứng COVID-19 khoảng 2-3 ngày bệnh nhân đã có các triệu chứng mệt mỏi, sốt, chán ăn và có tới 40% bệnh nhân có biểu hiện đau bụng. Sau đó nếu bệnh nặng lên, COVID-19 sẽ tấn công vào phổi và các cơ quan ngoài phổi”.
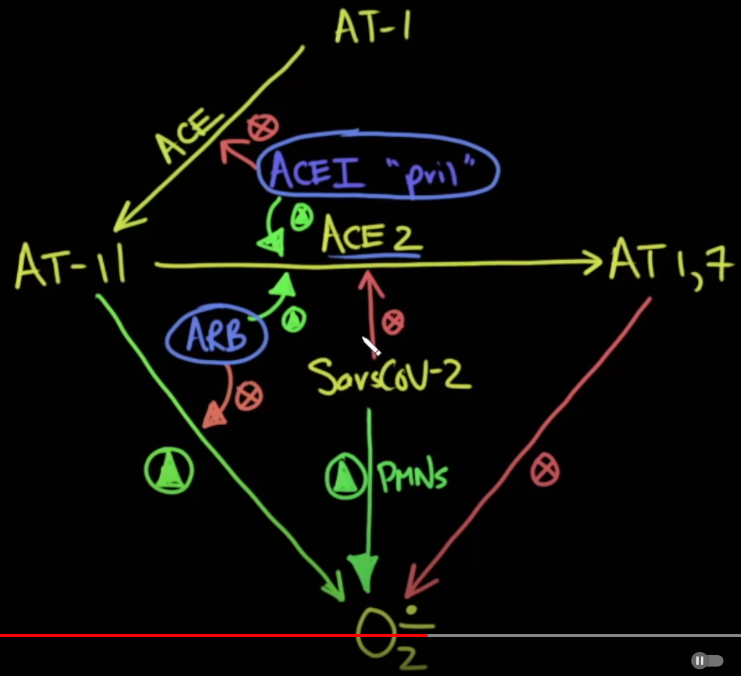
Mối liên quan trên được dấy lên vì sự liên quan đã được biết đến giữa enzym chuyển angiotensin 2 (ACE2) với virus SARS-CoV-2. ACE2 đã được chứng minh là một đồng thụ thể cho sự xâm nhập của virus SARS-CoV-2 và ngày càng nhiều bằng chứng cho thấy enzym này có vai trò kéo dài thời gian gây bệnh trong bệnh sinh của COVID-19. ACE2 có tỉ lệ biểu hiện rộng rãi trong cơ thể người, trong đó nhấn mạnh nhất là sự có mặt của enzym này tại hệ tiêu hóa, tim và thận. Bên cạnh đó, nhiều dữ liệu gần đây có báo cáo ACE2 còn xuất hiện trong các tế bào phế nang loại II ở phổi. Một số chuyên gia lo ngại rằng ACEI và ARB làm tăng gấp đôi mức độ nghiêm trọng và tỉ lệ tử vong của COVID-19. Một gợi ý đó là ACEI có thể ức chế trực tiếp ACE2 nhưng ACE2 hoạt động như một carboxypeptidase và không bị ức chế bởi các thuốc ACEI được kê đơn trên lâm sàng.
Ngoài ra, các chuyên gia cũng lo ngại việc sử dụng ACEI và ARB sẽ có thể làm tăng biểu hiện của ACE2, tăng tính nhạy cảm của bệnh nhân với sự xâm nhập và nhân lên của virus trong tế bào chủ. Nhiều bằng chứng thực nghiệm trên động vật cũng như một số bằng chứng trên người cho thấy sự gia tăng biểu hiện của ACE2 tại tim, não, và thậm chí trong nước tiểu sau khi điều trị bằng ARB, nhưng không có nhiều bằng chứng cho thấy sự thay đổi về nồng độ ACE2 trong huyết thanh hoặc phổi. Hơn nữa, tác động của sự biểu hiện ACE2 trong cơ chế bệnh sinh và tỉ lệ tử vong của COVID-19 vẫn chưa được biết đến rõ ràng.
Có một điều rất đáng quan tâm nữa là, các nhà nghiên cứu khác đã chỉ ra rằng có một phiên bản hòa tan của ACE2 không nằm trên màng tế bào, và nó có thể đóng vai trò như là mồi nhử để virus gắn vào, do đó, tế bào phổi không bị ảnh hưởng. Điều này có nghĩa là sự gia tăng của ACE2 hòa tan có thể có tác dụng bảo vệ. Do vậy, nếu các thuốc ức chế men chuyển (ACEI) và các thuốc chẹn thụ thể (ARB) làm tăng ACE2 hòa tan thì chúng thực sự có thể có lợi. Hiện tại, chúng ta không biết liệu ACE2 hòa tan có thể nhiễm virus hay không khi virus xâm nhập từ đường thở, nhưng nếu có ACE2 hòa tan trong lớp chất nhầy nằm ngay trên các tế bào phổi thì có thể có một tác dụng bảo vệ. Đây là một tín hiệu vui, nhưng có lẽ chúng ta cần kết quả của nhiều nghiên cứu hơn nữa để khẳng định tiềm năng lợi ích của tiếp cận điều trị mới này! [5]. (hình 3)
Hình 3: ACE2 hòa tan có thể là 1 trị liệu tiên phong COVID-10
Ngoài ra, nhiều nghiên cứu cho thấy, angiotensin II là cần thiết để cho xơ phổi xảy ra. Khi không có angiotensin II thì xơ phổi không xảy ra, và ít angiotensin II có thể có nghĩa là ít xơ phổi hơn. ACE2 đã được chứng minh là có tác dụng bảo vệ chống lại tổn thương phổi do coronavirus gây ra bằng cách tăng phá vỡ angiotensin II thành chất giãn mạch angiotensin 1-7. [6]. Cả bệnh nhân SARS và COVID-19 đã hồi phục đều bị sẹo phổi quá mức. Khi tế bào bị nhiễm coronavirus, sự tương tác giữa protein tăng đột biến của virus với ACE2 gây ra sự sụt giảm nồng độ ACE2 trong các tế bào thông qua quá trình nội hóa và thoái hóa protein, và do đó có thể góp phần gây tổn thương phổi, xơ phổi [7]. Do vậy, nếu các thuốc ức chế men chuyển (ACEI) và chẹn thụ thể (ARB) làm tăng ACE2 thì điều đó có thể bảo vệ chống lại xơ phổi và tổn thương nặng hơn. Đây cũng là 1 tiếp cận điều trị mới để chống lại COVID-19, tuy nhiên, cần có thời gian để làm sáng tỏ điều này!
ACE2 lần đầu tiên được phát hiện là thụ thể tương đồng với ACE vào năm 2000. ACE2 là protein xuyên màng, chủ yếu được neo ở bề mặt của tế bào. Miền xúc tác của nó nằm ở phía ngoại bào của tế bào, có thể được phân cắt và giải phóng vào máu bởi ADAM17 (một loại protein chứa protein disintegrin và metallicoproteinase 17). ACE2 chứa một domain xúc tác có độ tương đồng 42% với domain xúc tác của ACE. ACE2 chuyển Angiotensin I thành Angiotensin (1-9) và Angiotensin II thành Angiotensin (1-7). Angiotensin II là cơ chất được ưa thích của ACE2, có ái lực gấp 400 lần Angiotensin I. ACE2 có cơ chế điều hoà đối nghịch lại với ACE. Vì ACE2 điều hoà nồng độ của Ang II và giới hạn tác động của nó bằng cách chuyển Ang II thành Ang (1-7). Ang (1-7) gắn vào thụ thể MasR và sinh ra Bradykinin, phân tử gây giãn mạch và đáp ứng chống tăng sinh, ngoài ra nó còn có thể tạo ra NO và PGI2. Ở động vật có vú, sự giảm biểu hiện ACE2 có liên quan đến tăng huyết áp, giảm co bóp cơ tim và tăng nồng độ Ang II. Ngược lại biểu hiện quá mức ACE2 sẽ ngăn chặn tình trạng phì đại cơ tim do tác động của Ang II. Đồng thời ACE2 đóng vai trò như một thụ thể của Coronavirus [13].
|
Thuốc
|
Liều thông thường
|
Tác dụng phụ
|
|
Thuốc ức chế ACE*
|
||
|
Benazepril |
5-40 mg, một lần / ngày |
Phát ban, ho, phù mạch, tăng kali máu (đặc biệt ở những bệnh nhân suy thận hoặc dùng NSAIDs, thuốc lợi tiểu giữ kali hoặc dùng các chế phẩm bổ sung kali), chứng khó tiêu, tổn thương thận cấp có hồi phục nếu hẹp động mạch thận một bên hoặc cả 2 bên, Protein niệu (hiếm gặp với liều khuyến cáo), giảm bạch cầu trung tính (hiếm gặp), hạ huyết áp liều đầu (đặc biệt ở bệnh nhân có hoạt độ renin huyết tương cao hoặc giảm thể tích tuần hoàn do dùng thuốc lợi tiểu hoặc các bệnh lý khác) |
|
Captopril |
Liều 12,5-150 mg, 2 lần/ngày |
|
|
Enalapril |
2,5-40 mg, một lần / ngày |
|
|
Fosinopril |
10-80 mg, một lần / ngày |
|
|
Lisinopril |
5-40 mg, một lần / ngày |
|
|
Perindopril |
4-8 mg, 1 lần / ngày |
|
|
Quinapril |
5-80 mg, một lần / ngày |
|
|
Ramipril |
1,25-20 mg, một lần / ngày |
|
|
Trandolapril |
1-4 mg, 1 lần / ngày |
|
|
Thuốc chẹn thụ thể angiotensin II
|
||
|
Azilsartan |
80 mg, một lần / ngày Ở bệnh nhân> 65 tuổi, liều khởi đầu 40 mg, một lần / ngày |
Chóng mặt, phù mạch (rất hiếm gặp); về mặt lý thuyết, các thuốc này có tác dụng không mong muốn lên chức năng thận, kali máu và huyết áp tương tự như các thuốc ức chế ACE (trừ protein niệu và giảm bạch cầu). |
|
Candesartan |
8-32 mg, một lần / ngày |
|
|
Eprosartan |
400-1200 mg, một lần / ngày |
|
|
Irbesartan |
75-300 mg, một lần / ngày |
|
|
Losartan |
25-100 mg, một lần / ngày |
|
|
Olmesartan |
20-40 mg, một lần / ngày |
|
|
Telmisartan |
20-80 mg, một lần / ngày |
|
|
Valsartan |
80-320 mg, một lần / ngày |
|
|
* Tất cả các thuốc ức chế ACE và các thuốc chẹn thụ thể angiotensin II đều chống chỉ định với phụ nữ có thai (loại C trong 3 tháng đầu, loại D trong 3 tháng giữa và 3 tháng cuối). |
||
RAS và ACE2
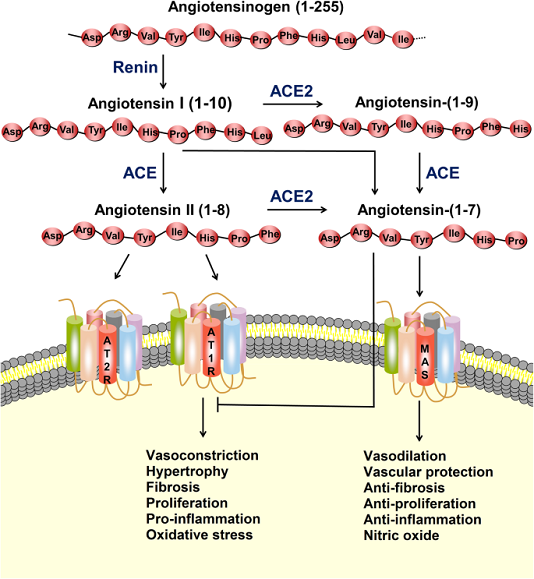
RAS là một mạng lưới phức tạp có vai trò quan trọng trong việc duy trì huyết áp cũng như cân bằng nội môi chất điện giải và dịch, ảnh hưởng đến chức năng của nhiều cơ quan, chẳng hạn như tim, mạch máu và thận. Angiotensin II (Ang-II), là peptide hoạt tính sinh học tiêu biểu nhất trong RAS, tham gia rộng rãi vào sự tiến triển của các bệnh tim mạch, chẳng hạn như tăng huyết áp, nhồi máu cơ tim và suy tim. Trong RAS cổ điển, renin phân cắt angiotensinogen cơ chất để tạo thành decapeptide angiotensin I (Ang-I), và sau đó, ACE loại bỏ hai axit amin ở đầu cuối carboxyl của Ang-I để tạo ra Ang-II (Hình 1). Cho đến nay, ba thụ thể Ang-II đã được xác định, và ái lực của những thụ thể này đối với Ang-II là tương tự nhau, trong phạm vi nano. Trong số các thụ thể này, thụ thể angiotensin type 1 (AT1R) liên kết với Ang-II, gây co mạch, tăng sinh tế bào, phản ứng viêm, đông máu và tái cấu trúc nền ngoại bào, trong khi thụ thể angiotensin type 2 (AT2R) chống lại các tác dụng nói trên do AT1R.
Hình 1
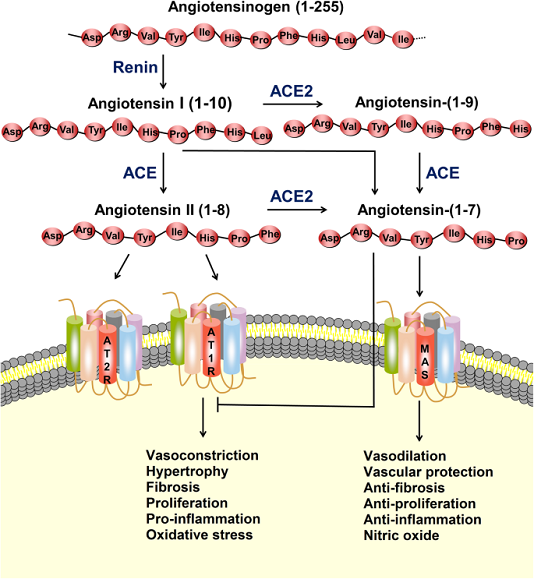
Hệ thống renin-angiotensin (RAS) và trục ACE2 / angiotensin- (1–7) / MAS. Protease renin chuyển đổi angiotensinogen thành Ang-I, sau đó được chuyển thành Ang-II bởi enzyme chuyển đổi angiotensin (ACE). Ang-II có thể liên kết với thụ thể angiotensin type 1 (AT1R) để thực hiện các hành động, chẳng hạn như co mạch, phì đại, xơ hóa, tăng sinh, viêm và stress oxy hóa. ACE2 có thể chuyển Ang-I và Ang-II thành angiotensin- (1–7). Angiotensin- (1-7) liên kết với thụ thể MAS để thực hiện các hành động giãn mạch, bảo vệ mạch máu, chống xơ hóa, chống tăng sinh và chống viêm. Ang-II cũng có thể liên kết với thụ thể angiotensin loại 2 (AT2R) để chống lại các tác dụng nói trên do AT1R trung gian
Năm 2000, hai nhóm nghiên cứu độc lập đã phát hiện ra ACE2, một chất tương đồng của ACE, có thể loại bỏ phenylalanin đầu tận cùng cacboxy trong Ang-II để tạo thành heptapeptide angiotensin- (1-7). Ngoài ra, dưới tác dụng xen kẽ của ACE2 và ACE, angiotensin- (1–7) có thể được hình thành mà không có Ang-II (Hình 1). Trong con đường chuyển hóa này, Ang-I đầu tiên được thủy phân bởi ACE2 để tạo thành angiotensin- (1–9), và angiotensin- (1–9) sau đó được thủy phân bởi ACE để tạo thành angiotensin- (1–7). Ang-I cũng có thể được chuyển đổi trực tiếp thành angiotensin- (1-7) bởi endopeptidase và oligopeptidases. Do ái lực cao hơn giữa ACE và Ang-I, con đường cổ điển của Ang-II thành angiotensin- (1-7) phổ biến hơn. Angiotensin- (1–7), như một phối tử, liên kết với MAS kết hợp với protein G, tạo ra tác dụng ngược lại với Ang-II, và thực hiện một loạt các chức năng ở nhiều cơ quan / hệ thống. Ngoài việc xúc tác sản xuất angiotensin- (1–7), ACE2 còn tham gia vào quá trình hấp thu các axit amin trong tế bào biểu mô ruột.
ACE2 làm trung gian lây nhiễm SARS-CoV-2
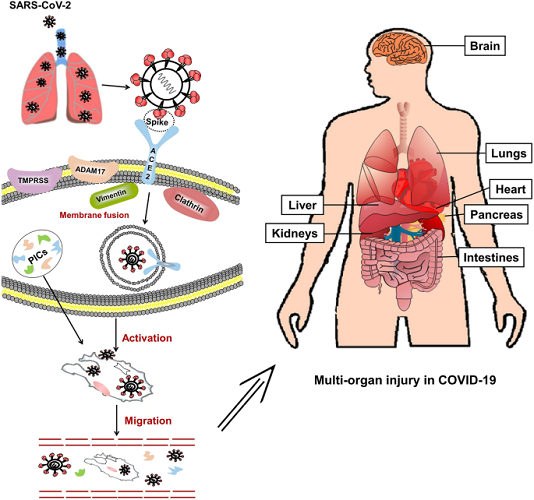
Sự xâm nhập vào tế bào vật chủ là bước đầu tiên của quá trình lây nhiễm virus. Một glycoprotein tăng đột biến trên vỏ virus của coronavirus có thể liên kết với các thụ thể cụ thể trên màng tế bào chủ. Các nghiên cứu trước đây đã chỉ ra rằng ACE2 là một thụ thể chức năng cụ thể đối với SARS-CoV. Zhou và cộng sự. cho thấy SARS-CoV-2 có thể xâm nhập vào các tế bào biểu hiện ACE2, nhưng không vào các tế bào không có ACE2 hoặc các tế bào biểu hiện các thụ thể coronavirus khác, chẳng hạn như aminopeptidase N và dipeptidyl peptidase 4 (DPP4), xác nhận rằng ACE2 là thụ thể tế bào cho SARS-CoV- 2. Các nghiên cứu sâu hơn cho thấy ái lực liên kết của glycoprotein tăng đột biến SARS-CoV-2 với ACE2 cao hơn từ 10 đến 20 lần so với của SARS-CoV với ACE2. Cơ chế có thể xảy ra khi SARS-CoV-2 xâm nhập vào tế bào chủ dựa trên các nghiên cứu về SARS-CoV được trình bày trong Hình 2 . Tóm lại, miền liên kết thụ thể của glycoprotein tăng đột biến liên kết với đầu miền phụ I của ACE2. Sự kết hợp màng của vi rút và tế bào chủ được kích hoạt sau khi liên kết, và RNA của vi rút sau đó được phóng thích vào tế bào chất, tạo nên sự lây nhiễm. Đối với nhiễm trùng SARS-CoV, ACE2 còn nguyên vẹn hoặc miền xuyên màng của nó được xâm nhập vào bên trong cùng với vi rút. Vị trí hoạt động xúc tác của ACE2 không bị chặn bởi glycoprotein tăng đột biến, và quá trình liên kết độc lập với hoạt tính peptidase của ACE2. Một số proteinase xuyên màng (chẳng hạn như vùng disgrin và metallopeptidase 17 [ADAM17], protease serine xuyên màng 2 [TMPRSS2] và enzym chuyển TNF) và các protein (như vimentin và clathrin) có thể tham gia vào quá trình liên kết và dung hợp màng. Ví dụ, ADAM17 có thể phân cắt ACE2 để gây rụng ectodomain, và TMPRSS2 có thể phân cắt ACE2 để thúc đẩy sự hấp thu của virus.
Hình 2
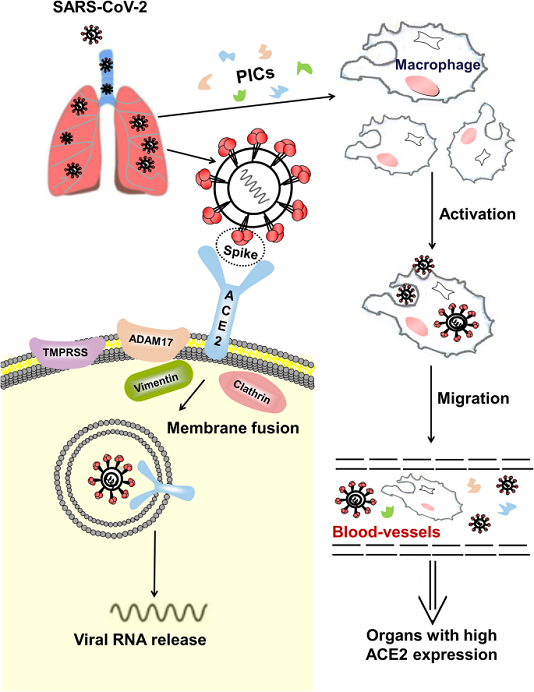
Một mô hình cho quá trình SARS-CoV-2 xâm nhập vào tế bào vật chủ trong phổi và tấn công các cơ quan khác. SARS-CoV-2 xâm nhập vào phổi, nơi glycoprotein tăng đột biến của vi rút liên kết với ACE2 trên tế bào, cho phép vi rút xâm nhập vào tế bào. Một số proteinase xuyên màng, chẳng hạn như protease xuyên màng serine 2 (TMPRSS2) và vùng phân rã metallopeptidase 17 (ADAM17) cũng tham gia vào quá trình này. Ví dụ, SARS-CoV-2 có thể sử dụng TMPRSS2 để mồi protein tăng đột biến trong các dòng tế bào. Các tế bào bị nhiễm và các tế bào viêm được kích thích bởi các kháng nguyên virus có thể tạo ra các cytokine gây viêm (PIC) và chemokine để kích hoạt các phản ứng miễn dịch và phản ứng viêm để chống lại virus. Các vi rút thực bào không có tế bào và đại thực bào trong máu có thể được truyền đến các cơ quan khác và lây nhiễm sang các tế bào biểu hiện ACE2 tại các vị trí cục bộ
ACE2 được biểu hiện trong hầu hết các cơ quan của con người ở các mức độ khác nhau. Trong hệ hô hấp, phương pháp hóa mô miễn dịch truyền thống và phân tích RNA-seq đơn bào được giới thiệu gần đây cho thấy ACE2 chủ yếu biểu hiện trên tế bào biểu mô phế nang loại II, nhưng biểu hiện yếu trên bề mặt tế bào biểu mô ở niêm mạc miệng, mũi và vòm họng, cho thấy phổi là mục tiêu chính của SARS-CoV-2. Hơn nữa, ACE2 được biểu hiện nhiều trên tế bào cơ tim, tế bào ống lượn gần của thận và tế bào biểu mô bàng quang, và được biểu hiện nhiều trên các tế bào ruột của ruột non, đặc biệt là ở hồi tràng. Virus liên quan đến thực bào không tế bào và đại thực bào có thể lây lan từ phổi đến các cơ quan khác với biểu hiện ACE2 cao thông qua tuần hoàn máu (Hình 2 ). Ví dụ, có tới 67% bệnh nhân bị tiêu chảy trong đợt SARS và khá nhiều bệnh nhân bị COVID-19 có các triệu chứng về ruột. Sự sao chép tích cực của virus trong các tế bào ruột của ruột non đã được báo cáo và SARS-CoV-2 đã được phân lập thành công từ các mẫu phân.
ACE2 có liên quan đến tổn thương đa cơ quan trong COVID-19
Khám nghiệm tử thi bệnh nhân SARS cho thấy nhiễm SARS-CoV có thể gây tổn thương cho nhiều cơ quan như tim, thận, gan, cơ xương, hệ thần kinh trung ương, tuyến thượng thận và tuyến giáp, bên cạnh phổi. Hầu hết các bệnh nhân nặng với COVID-19 cũng bị tổn thương nhiều cơ quan, bao gồm tổn thương phổi cấp tính, tổn thương thận cấp tính, tổn thương tim, rối loạn chức năng gan và tràn khí màng phổi. Cũng như SARS và COVID-19, tổn thương nội tạng cũng thường được quan sát thấy ở MERS, đặc biệt là đường tiêu hóa và thận, trong khi tỷ lệ tổn thương tim cấp tính ít phổ biến hơn. Không giống như SARS-CoV và SARS-CoV-2, MESR-CoV sử dụng DPP4 làm thụ thể xâm nhập của nó, chủ yếu được biểu hiện trên các tế bào phổi, tế bào biểu mô đa nhân và tế bào tuyến dưới niêm mạc phế quản của phổi; tế bào biểu mô của thận và ruột non; và bạch cầu hoạt hóa. DPP4 không được biểu hiện nhiều trên các tế bào cơ tim. Do đó, điều này chỉ ra rằng sự liên quan và tổn thương của các cơ quan có liên quan chặt chẽ đến sự phân bố thụ thể trong cơ thể.
Theo kết quả của một loạt nghiên cứu về SARS, cơ chế bệnh sinh của COVID-19 rất phức tạp. Các phản ứng viêm do virus gây ra, bao gồm sự biểu hiện quá mức của cytokine và chemokine, tuyển dụng quá nhiều tế bào viêm, đáp ứng interferon không đủ và khả năng sản xuất kháng thể tự động được coi là những yếu tố quan trọng trong quá trình sinh bệnh. Các cytokine chống viêm (PIC) và chemokine trong huyết tương, chẳng hạn như interleukin (IL) -1, IL-6, IL-12, IL-8, protein hóa trị đơn bào-1 (MCP-1) và interferon-gamma-inducible protein 10 (IP-10), tăng cao đáng kể trong huyết tương của bệnh nhân SARS. Nồng độ trong huyết tương của các PIC này tăng lên đáng kể cũng được tìm thấy ở những bệnh nhân nặng với COVID-19. Các nghiên cứu khám nghiệm tử thi bệnh nhân SARS còn phát hiện ra rằng PIC và MCP-1 được biểu hiện nhiều trong các tế bào ACE2 + nhiễm SARS-CoV, nhưng không phải trong các mô không có tế bào ACE2 + bị nhiễm, cho thấy tổn thương qua trung gian miễn dịch tại chỗ do virus gây ra.
Ngoài việc hoạt động như một thụ thể đối với SARS-CoV và SARS-CoV-2, ACE2 thủy phân Ang-II thành angiotensin- (1–7) và ACE2 / angiotensin- (1–7) / MAS chống lại các tác động tiêu cực của RAS và có tác dụng chống viêm. Một số nghiên cứu đã chỉ ra rằng nhiễm SARS-CoV có thể điều chỉnh giảm biểu hiện ACE2 trên tế bào, do đó phá vỡ sự cân bằng sinh lý giữa ACE / ACE2 và Ang-II / angiotensin- (1-7) và sau đó gây ra tổn thương cơ quan nghiêm trọng. Cho rằng SARS-CoV-2 là một loài coronavirus liên quan đến SARS và sử dụng ACE2 làm thụ thể của nó, sự điều hòa giảm biểu hiện ACE2 có thể liên quan đến tổn thương đa cơ quan trong COVID-19.
Dựa trên các nghiên cứu trước đây về SARS và các nghiên cứu gần đây về SARS-CoV-2, tổn thương đa cơ quan trong COVID-19 (Hình 3) và vai trò có thể có của ACE2 trong tổn thương nội tạng được mô tả dưới đây.
Hình 3
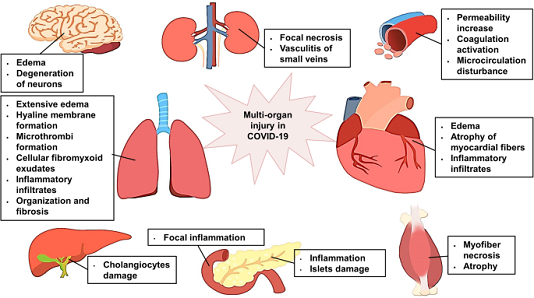
Các cơ quan chính liên quan đến COVID-19
Tổn thương phổi cấp
Mặc dù tỷ lệ tử vong ở COVID-19 thấp hơn so với SARS và MERS, nhiều bệnh nhân bị tổn thương phổi cấp tính (ALI) sau khi nhiễm trùng. Tương tự như các đặc điểm bệnh lý của SARS và MERS, tổn thương phế nang lan tỏa nghiêm trọng, chẳng hạn như phù nề rộng, hình thành màng hyalin, thâm nhiễm viêm, hình thành microthrombi, tổ chức và xơ hóa, cũng được quan sát thấy trong COVID-19, nhưng với dịch tiết fibromyxoid tế bào nhiều hơn ở các phế nang và đường dẫn khí nhỏ. Vai trò của RAS và ACE2 trong ARDS/ALI đã thu hút sự chú ý lớn kể từ khi dịch SARS bùng phát vào năm 2003. Các nghiên cứu lâm sàng đã phát hiện ra rằng đa hình chèn/xóa ACE có thể tương quan với mức độ nghiêm trọng của ARDS. Mức Ang-II cao trong phổi có thể làm tăng tính thấm thành mạch và gây phù phổi. Một số nghiên cứu đã tiết lộ tác dụng bảo vệ của trục ACE2/angiotensin- (1–7) / MAS trong phổi. Nó làm giảm viêm phổi, xơ hóa và tăng áp động mạch phổi, cũng như ức chế sự phát triển của tế bào ung thư, hình thành mạch khối u và di căn khối u. Trong các mô hình động vật khác nhau về ALI, chuột loại trực tiếp ACE2 cho thấy tính thấm thành mạch được tăng cường, tăng phù phổi, tích tụ bạch cầu trung tính và chức năng phổi xấu đi rõ rệt so với chuột đối chứng kiểu hoang dã. Tiêm protein ACE2 tái tổ hợp của người hoặc thuốc chẹn AT1R vào chuột loại trực tiếp ACE2 có thể làm giảm mức độ ALI.
Nhiễm SARS-CoV làm giảm đáng kể biểu hiện của ACE2 trong phổi chuột. Các thí nghiệm tiếp theo cho thấy rằng chỉ gắn kết đột biến SARS-CoV-Fc tái tổ hợp với ACE2 của người và chuột có thể dẫn đến sự điều hòa giảm biểu hiện ACE2 trên bề mặt tế bào. Protein Fc tăng đột biến làm trầm trọng thêm ALI do axit gây ra ở chuột hoang dã, nhưng không ảnh hưởng đến mức độ nghiêm trọng của suy phổi ở chuột loại trực tiếp ACE2, cho thấy rằng ảnh hưởng của protein đột biến lên ALI là đặc hiệu của ACE2. Các nghiên cứu về bệnh cúm cũng cho thấy ACE2 được điều chỉnh giảm đáng kể sau khi nhiễm H1N1. Thiếu ACE2 làm trầm trọng thêm cơ chế bệnh sinh ở những con chuột bị nhiễm bệnh, và sự ức chế AT1 làm giảm mức độ nghiêm trọng của tổn thương phổi do vi rút cúm H7N9 gây ra. Hơn nữa, nồng độ Ang-II tăng cao ở bệnh nhân nhiễm H5N1 và H7N9, có liên quan đến mức độ nghiêm trọng của tổn thương phổi và dự đoán kết quả tử vong ở bệnh nhân nhiễm H7N9. Ở những bệnh nhân bị COVID-19, nồng độ Ang-II trong huyết tương tăng cao rõ rệt và có liên quan tuyến tính với tải lượng virus và tổn thương phổi. Tất cả những phát hiện này cho thấy rằng giảm điều hòa RAS và ACE2 góp phần vào cơ chế bệnh sinh của tổn thương phổi ở COVID-19.
Tổn thương tim cấp tính
Tim biểu hiện rất nhiều ACE2, cho thấy rằng nó dễ bị nhiễm SARS-Cov-2. Khám nghiệm tử thi bệnh nhân SARS cho thấy 35% trong số họ (7 trong số 20 người) dương tính với bộ gen SARS-CoV trong mô tim, và bệnh nhân nhiễm trùng tim SARS-CoV có bệnh nặng hơn và tử vong sớm hơn những người không mắc bệnh . Phù nề mô cơ tim, thâm nhiễm tế bào viêm và teo các sợi cơ tim đã được quan sát thấy ở bệnh nhân SARS và tổn thương cơ tim. Tổn thương tim khá phổ biến ở những bệnh nhân bị bệnh nặng với COVID-19, và chúng tôi nhận thấy rằng tổn thương cơ tim cấp tính sớm có liên quan đến nguy cơ tử vong cao hơn.
Vai trò có lợi của trục ACE2/angiotensin- (1–7) / MAS trong tim đã được chứng minh rõ ràng. Nó có thể tạo ra sự điều hòa mạch vành, ức chế stress oxy hóa, làm giảm quá trình tái tạo tim bệnh lý và cải thiện chức năng tim sau thiếu máu cục bộ. Biểu hiện ACE2 thường tăng ở giai đoạn đầu của tổn thương tim, nhưng giảm khi bệnh tiến triển. Loại trực tiếp ACE2 ở chuột dẫn đến phì đại cơ tim và xơ hóa mô kẽ và làm tăng tốc độ suy tim. Ngoài ra, loại trực tiếp ACE2 ở chuột làm trầm trọng thêm rối loạn chức năng tim do bệnh tiểu đường. Ở cả chuột và người bị nhiễm SARS-CoV, biểu hiện ACE2 trong tế bào cơ tim được điều hòa giảm rõ rệt ở tim. Theo các nghiên cứu gần đây và dữ liệu của chúng tôi, một số lượng đáng kể bệnh nhân mắc bệnh nặng có tăng huyết áp như một bệnh đi kèm. Việc kích hoạt quá mức RAS có thể đã xảy ra ở những người này trước khi lây nhiễm. Sự điều hòa giảm đáng kể của ACE2 và điều hòa Ang-II trong COVID-19 dẫn đến sự hoạt hóa quá mức của RAS và làm mất tác dụng bảo vệ của angiotensin- (1-7) có thể làm trầm trọng thêm và kéo dài chấn thương tim.
Tổn thương hệ tiêu hóa
Đường tiêu hóa, đặc biệt là ruột, dễ bị nhiễm trùng SARS-CoV và SARS-CoV-2. Các hạt SARS-CoV đã được phát hiện trong tế bào biểu mô của niêm mạc ruột, nhưng không có trong thực quản và dạ dày. Phát hiện bệnh lý chính ở ruột của bệnh nhân SARS là sự suy giảm mô bạch huyết niêm mạc. Chỉ phát hiện được viêm khu trú nhẹ ở đường tiêu hóa. Những phát hiện này có thể giải thích tại sao các biểu hiện tiêu hóa ở COVID-19 không nghiêm trọng và chỉ thoáng qua.
Nhiều bệnh nhân mắc COVID-19 có biểu hiện tăng nhẹ đến trung bình nồng độ alanin aminotransferase (ALT) và / hoặc aspartate aminotransferase (AST) trong huyết thanh trong quá trình nhiễm trùng. Khám nghiệm tử thi bệnh nhân SARS cho thấy thoái hóa mỡ, hoại tử tế bào gan và thâm nhiễm tế bào trong gan. Tuy nhiên, SARS-CoV không được phát hiện trong mô gan của hầu hết bệnh nhân được khám nghiệm tử thi. Cả phân tích hóa mô miễn dịch và phân tích RNA-seq tế bào đơn cho thấy tế bào gan, tế bào Kupffer và lớp nội mô của hình sin đều âm tính với ACE2; chỉ có tế bào mật dương tính với ACE2. Gamma-glutamyl transpeptidase (GGT), phản ánh tổn thương tế bào mật, đã tăng cao ở một số bệnh nhân COVID-19. Những phát hiện này chỉ ra rằng hầu hết tổn thương gan cấp tính có thể không phải do nhiễm vi rút, mà rất có thể do các nguyên nhân khác, chẳng hạn như nhiễm độc gan do thuốc, thiếu oxy và viêm toàn thân. Liệu SARS-CoV-2 có gây tổn thương đường mật do liên kết với ACE2 trên tế bào mật hay không thì cần phải điều tra thêm.
Tổn thương thận cấp tính
ACE2 được biểu hiện nhiều ở thận, đặc biệt là ở màng đỉnh của tế bào biểu mô ống lượn gần, cho thấy thận là một mục tiêu khác của SARS-CoV-2. Hơn nữa, sự mất cân bằng giữa Ang-II và angiotensin- (1–7) do thiếu ACE2 có thể làm trầm trọng thêm tình trạng tổn thương của thận trước các yếu tố khác gây ra chấn thương thận cấp tính (AKI). SARS-CoV được phát hiện trong tế bào biểu mô của ống lượn xa, và trình tự virus được xác định trong mẫu nước tiểu của một số bệnh nhân. SARS-CoV-2 cũng đã được phân lập từ các mẫu nước tiểu. Một phân tích hồi cứu trên 536 bệnh nhân SARS cho thấy 6,7% bệnh nhân bị suy thận cấp tính trong suốt quá trình của bệnh. Một nghiên cứu thuần tập lớn từ New York cho thấy tỷ lệ AKI ở bệnh nhân COVID-19 có thể lên tới 36,6%.
Tổn thương cơ quan và mô khác
Tuyến tụy
Tế bào tuyến tụy biểu hiện rất cao ACE2, cho thấy COVID-19 có thể ảnh hưởng đến tuyến tụy. Người ta đã báo cáo rằng có đến 16% bệnh nhân bị COVID-19 nặng có nồng độ amylase và lipase huyết thanh tăng, với 7% cho thấy những thay đổi đáng kể ở tuyến tụy trên phim chụp CT. Biểu hiện lâm sàng của viêm tụy cấp đã được báo cáo ở bệnh nhân COVID-19. ACE2 / angiotensin- (1–7) đóng vai trò bảo vệ trong bệnh tiểu đường bằng cách cải thiện sự sống còn của tế bào β tuyến tụy, kích thích bài tiết insulin và giảm đề kháng insulin. Các nghiên cứu đã chỉ ra rằng, so với những bệnh nhân bị viêm phổi không do SARS, nhiều bệnh nhân SARS không bị tiểu đường trước đó và không được điều trị steroid đã phát triển thành bệnh tiểu đường cấp phụ thuộc insulin khi nhập viện. Hơn nữa, nồng độ glucose huyết tương và bệnh tiểu đường là những yếu tố dự báo độc lập về tỷ lệ tử vong ở bệnh nhân SARS. Khám nghiệm tử thi một số bệnh nhân SARS cho thấy teo và thoái hóa amyloid ở hầu hết các đảo nhỏ của tuyến tụy, cho thấy vi rút gây tổn thương các đảo nhỏ. Do đó, COVID-19 cũng có thể ảnh hưởng đến chức năng tuyến tụy, tương tự như SARS, và nồng độ glucose cần được theo dõi chặt chẽ, đặc biệt ở những bệnh nhân bị tiểu đường hoặc đang điều trị bằng glucocorticoid.
Cơ xương
Yếu cơ và tăng nồng độ creatine kinase (CK) trong huyết thanh được quan sát thấy ở hơn 30% bệnh nhân SARS. Nồng độ CK tăng nhẹ đến trung bình cũng được quan sát thấy ở bệnh nhân COVID-19 khi nhập viện. Hoại tử và teo sợi cơ đã được quan sát thấy trong các mô cơ xương, nhưng không có hạt SARS-CoV nào được phát hiện bằng kính hiển vi điện tử. Các nghiên cứu gần đây cho thấy RAS đóng một vai trò quan trọng trong bệnh sinh của các rối loạn cơ xương khác nhau, và trục ACE2 / angiotensin- (1–7) / MAS có tác dụng bảo vệ chống lại chứng teo cơ. Tuy nhiên, liệu SARS-CoV-2 có tấn công các cơ hay không và liệu sự giảm điều hòa của ACE2 có liên quan đến bệnh cơ hay không vẫn chưa rõ ràng.
Hệ thần kinh trung ương
ACE2 hiện diện rộng rãi trong não, chủ yếu ở các tế bào thần kinh và tham gia vào quá trình điều hòa thần kinh của các chức năng sinh lý rộng, chẳng hạn như các hoạt động tim mạch và trao đổi chất, phản ứng với căng thẳng và hình thành thần kinh. Trong mô hình chuột, SARS-CoV xâm nhập não qua khứu giác và sau đó lan truyền qua dây thần kinh đến các khu vực khác. Rối loạn chức năng khứu giác đã được báo cáo ở nhiều bệnh nhân bị COVID-19, cho thấy sự liên quan của khứu giác trong nhiễm trùng SARS-CoV-2. SARS-CoV được phân lập từ các mẫu mô não người. Khám nghiệm tử thi cho thấy phù nề và thoái hóa khu trú của tế bào thần kinh trong não của bệnh nhân SARS. Nhiều bệnh nhân (78/214) có biểu hiện thần kinh ở COVID-19, và SARS-CoV-2 được phát hiện trong dịch não tủy của một bệnh nhân bị viêm não. Xét rằng SARS-CoV-2 có ái lực với thụ thể của nó (ACE2) cao hơn nhiều so với SARS-CoV, thụ thể trước đây có thể có khả năng lây nhiễm và làm tổn thương hệ thần kinh trung ương.
Mạch máu
ACE2 cũng được biểu hiện trong các tế bào nội mô của các mạch máu nhỏ và lớn, và lớp nội mạc mạch máu có thể tạo ra angiotensin- (1–7). Trục ACE2 / angiotensin- (1–7) / MAS gây ra tác dụng giãn mạch, chống tăng sinh và chống huyết khối trong hệ mạch. RNA SARS có thể được phát hiện trong nội mô của các tĩnh mạch nhỏ ở nhiều mô. Nồng độ D-dimer trong huyết tương tăng đáng kể ở những bệnh nhân bị bệnh nặng với COVID-19, và sự xuất hiện của đông máu nội mạch lan tỏa (DIC) ở giai đoạn đầu của bệnh không hiếm. Nhiễm virus và các phản ứng viêm làm hỏng tính toàn vẹn của nội mạc mạch máu, gây tăng tính thấm, kích hoạt đông máu và rối loạn vi tuần hoàn, có thể góp phần gây tổn thương cơ quan trong COVID-19.
Mục tiêu tiềm năng và thuốc
Vì ACE2 là thụ thể cho cả SARS-CoV và SARS-CoV-2, và một số proteinase xuyên màng như ADAM17 và TMPRSS có liên quan đến quá trình liên kết và dung hợp màng, những vị trí này có thể là mục tiêu tiềm năng trong việc phát triển thuốc kháng vi-rút COVID- 19 điều trị. Ví dụ, các mẫu huyết thanh từ bệnh nhân SARS đang dưỡng bệnh có thể vô hiệu hóa sự xâm nhập theo hướng tăng đột biến của SARS-CoV-2 vào tế bào vật chủ, cho thấy rằng vắc-xin nhắm mục tiêu vào protein đột biến sẽ có triển vọng. Các nghiên cứu đã phát hiện ra rằng các kháng thể đơn dòng đặc hiệu SARS-CoV và ACE2-Ig tái tổ hợp có thể vô hiệu hóa một cách mạnh mẽ SARS-CoV-2 và một hexapeptide của vùng liên kết thụ thể của protein đột biến liên kết với ACE2, do đó ngăn chặn sự xâm nhập của SARS-CoV.
Sự điều hòa của ACE2 trong các cơ quan sau khi nhiễm virus làm rối loạn cân bằng cục bộ giữa trục RAS và ACE2 / angiotensin- (1–7) / MAS, có thể liên quan đến chấn thương cơ quan. Các nghiên cứu trên động vật đã phát hiện ra rằng liệu pháp ức chế men chuyển (ACEI) có thể làm tăng nồng độ angiotensin- (1-7) trong huyết tương, giảm nồng độ Ang-II trong huyết tương và tăng biểu hiện ACE2 ở tim, trong khi thuốc chẹn thụ thể angiotensin II (ARB) có thể làm tăng nồng độ trong huyết tương của cả Ang-II và angiotensin- (1–7) cũng như biểu hiện và hoạt động của tim của ACE2. Do đó, việc sử dụng ACEI/ARB, chất ức chế renin và các chất tương tự angiotensin- (1-7) có thể làm giảm tổn thương cơ quan bằng cách ngăn chặn con đường renin-angiotensin và / hoặc tăng mức angiotensin- (1-7). Các nghiên cứu trên động vật khác cho thấy ALI qua trung gian của SARS-CoV tăng đột biến hoặc vi rút cúm ở chuột có thể được cứu sống bằng cách sử dụng ARBs. Trong một nghiên cứu dựa trên dân số, việc áp dụng ACEI và ARB làm giảm đáng kể tỷ lệ tử vong trong 30 ngày của bệnh nhân viêm phổi cần nhập viện. Cũng có những lo ngại rằng điều trị bằng ƯCMC/ARB có thể tạo điều kiện cho nhiễm trùng và làm tăng nguy cơ phát triển COVID-19 nghiêm trọng và gây tử vong do tăng mức độ biểu hiện ACE2 trong các cơ quan đích. Tuy nhiên, hai nghiên cứu thuần tập lớn cho thấy việc sử dụng ƯCMC/ARB không liên quan đến tăng nhiễm SARS-CoV-2, nhưng có liên quan đến giảm nguy cơ tử vong do mọi nguyên nhân ở bệnh nhân nhập viện. Cần có các nghiên cứu sâu hơn để kiểm tra tác dụng bảo vệ của ACEI/ARB trong COVID-19.