Sự xâm lấn và DI CĂN trong ung thư: hiểu biết phân tử và mục tiêu điều trị – Bài rất dài
Sự xâm lấn và di căn trong ung thư: hiểu biết phân tử và mục tiêu điều trị
Trừu tượng
Sự tiến triển của các khối u ác tính dẫn đến sự phát triển của các khối u thứ phát ở các cơ quan khác nhau, bao gồm xương, não, gan và phổi. Quá trình di căn này ảnh hưởng nghiêm trọng đến tiên lượng của bệnh nhân, ảnh hưởng đáng kể đến chất lượng cuộc sống và tỷ lệ sống sót của họ. Các nỗ lực nghiên cứu đã liên tục tập trung vào các cơ chế phức tạp cơ bản của quá trình này và các chiến lược quản lý lâm sàng tương ứng. Do đó, sự hiểu biết toàn diện về cơ sở sinh học của di căn khối u, xác định các con đường tín hiệu quan trọng và đánh giá có hệ thống các chiến lược điều trị hiện có và mới nổi là điều tối quan trọng để nâng cao khả năng chẩn đoán và điều trị tổng thể cho các khối u di căn. Tuy nhiên, nghiên cứu hiện tại chủ yếu tập trung vào di căn trong các loại ung thư cụ thể, để lại những khoảng trống đáng kể trong hiểu biết của chúng ta về dòng thác di căn phức tạp, cơ chế tropism cụ thể của cơ quan và sự phát triển của các phương pháp điều trị nhắm mục tiêu. Trong nghiên cứu này, chúng tôi kiểm tra các quá trình tuần tự của di căn khối u, làm sáng tỏ các cơ chế cơ bản thúc đẩy di căn nhiệt đới cơ quan và phân tích một cách có hệ thống các chiến lược điều trị cho các khối u di căn, bao gồm cả những chiến lược phù hợp với sự tham gia của các cơ quan cụ thể. Sau đó, chúng tôi tổng hợp những tiến bộ gần đây nhất trong các công nghệ điều trị mới nổi cho di căn khối u và phân tích những thách thức và cơ hội gặp phải trong nghiên cứu lâm sàng liên quan đến di căn xương. Mục tiêu của chúng tôi là cung cấp thông tin chi tiết có thể cung cấp thông tin cho nghiên cứu và thực hành lâm sàng trong tương lai trong lĩnh vực quan trọng này.
Giới thiệu
Di căn khối u đại diện cho một sự kiện quan trọng trong sự tiến triển của bệnh ác tính, chiếm hơn 90% số ca tử vong liên quan đến ung thư và đặt ra một thách thức ghê gớm đối với việc quản lý lâm sàng của đại đa số bệnh nhân ung thư tiến triển. 1,2,3 Quá trình phức tạp này bao gồm sự tăng sinh không kiểm soát của các ổ khối u nguyên phát và sự di chuyển của các tế bào ung thư qua các hàng rào mô, góp phần gây ra các tổn thương mới ở các cơ quan ở xa. Điều này ảnh hưởng đáng kể đến tỷ lệ sống sót và chất lượng cuộc sống của bệnh nhân. 4,5,6 Sự đa hình và phức tạp của di căn khối u được thể hiện rõ ràng trong tác động của nó đối với hầu hết các cơ quan quan trọng trên khắp cơ thể, bao gồm phổi, gan, não và xương. Sự tương tác phức tạp giữa các tế bào ung thư và môi trường vi mô của cơ quan mục tiêu đại diện cho cốt lõi của dòng di căn này. Sự tương tác này liên quan đến những thay đổi năng động trong nhiều cytokine, yếu tố tăng trưởng và con đường tín hiệu, cùng nhau tạo ra một môi trường vi mô có lợi cho sự phát triển và lan tỏa của khối u 7,8,9 (Hình E). 1).
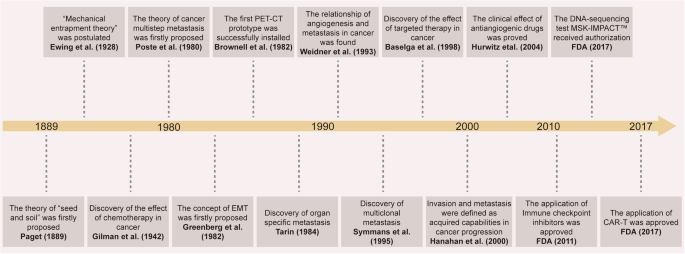
Tiến triển lịch sử trong nghiên cứu di căn ung thư: từ việc khám phá các cơ chế lý thuyết quan trọng đến ứng dụng thuốc lâm sàng. Cơ quan quản lý thực phẩm và dược phẩm của FDA
Mặc dù những tiến bộ đáng kể đã được thực hiện trong nghiên cứu cơ bản về di căn khối u, nhưng việc chuyển những phát hiện này vào thực hành lâm sàng một cách hiệu quả vẫn là một thách thức đáng kể. Các nghiên cứu lâm sàng hiện tại thường ưu tiên phát triển và đánh giá các phương pháp điều trị bằng thuốc, với sự thiếu nhấn mạnh tương đối vào sự hiểu biết toàn diện về cơ chế di căn, các cơ chế cụ thể cơ bản của di căn đặc hiệu cơ quan và khám phá các liệu pháp nhắm mục tiêu. Do đó, đánh giá này nhằm mục đích kiểm tra bản chất đa chiều của di căn khối u, chủ yếu tập trung vào di căn xương, não, gan và phổi như các đại diện nguyên mẫu. Bằng cách tích hợp lý thuyết “hạt giống và đất” với lý thuyết “di căn đa dòng”, chúng tôi nhằm mục đích phân tích sự tương tác giữa các tế bào khối u và môi trường vi mô của các cơ quan khác nhau, từ đó khám phá ra các con đường tín hiệu quan trọng và cơ chế điều hòa cơ bản của di căn. Hơn nữa, một đánh giá toàn diện về nghiên cứu và thử nghiệm lâm sàng hiện có sẽ được tiến hành để đánh giá hiệu quả của các chiến lược quản lý dược lý, không dùng thuốc và toàn diện trong điều trị di căn khối u. Mục tiêu của nỗ lực này là cung cấp một cơ sở khoa học và toàn diện hơn cho việc quản lý lâm sàng di căn khối u. Chúng tôi mong muốn xác định những thách thức chính trong lĩnh vực này và đề xuất các giải pháp có tư duy tiến bộ, với mục tiêu cuối cùng là thúc đẩy việc tối ưu hóa và tiến bộ liên tục các chiến lược chẩn đoán và điều trị cho di căn khối u.
Ý nghĩa lâm sàng của di căn ung thư
Di căn đại diện cho một đặc điểm xác định của bệnh ác tính, với vai trò nhân quả được ghi nhận trong hơn 90% trường hợp tử vong liên quan đến ung thư. 10 Não, phổi, gan và xương là những vị trí di căn phổ biến nhất, với các loại ung thư khác nhau thể hiện các mô hình lan tỏa riêng biệt đến các cơ quan hoặc mô cụ thể11 (Bảng 1). Ái lực cơ quan này chỉ ra rằng di căn được thúc đẩy bởi các cơ chế sinh học phức tạp chứ không chỉ là mối tương quan thống kê đơn thuần. 12 Hiểu biết toàn diện về dịch tễ học của di căn ung thư là điều cần thiết để xác định các nhóm dân số có nguy cơ cao và phát triển các chương trình sàng lọc nhắm mục tiêu. Nhận biết các xu hướng cụ thể của các cơ quan trong các bệnh ung thư khác nhau tạo điều kiện cho các bác sĩ lâm sàng theo dõi và quản lý bệnh nhân hiệu quả hơn. Kiến thức này rất quan trọng để cải thiện kết quả của bệnh nhân và giảm gánh nặng toàn cầu về tỷ lệ tử vong liên quan đến ung thư (Hình E). 2).
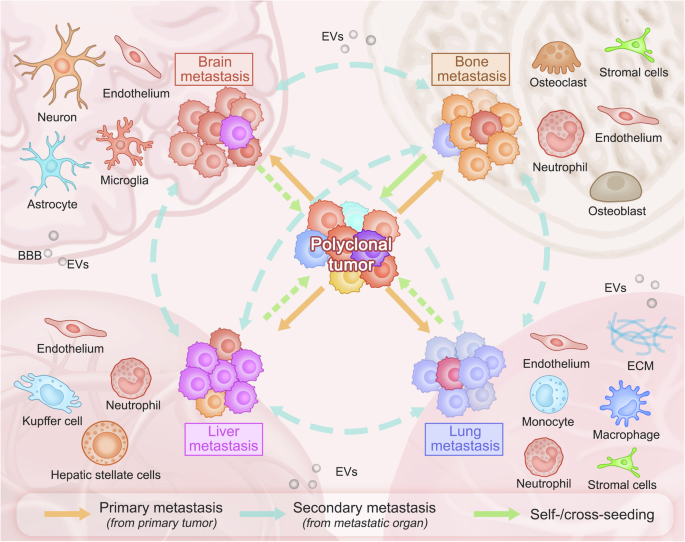
Di căn tế bào ung thư. Các tế bào khối u có sự không ổn định bộ gen vốn có tích tụ các đột biến dẫn đến sự không đồng nhất đáng kể. Di căn liên quan đến sự xâm nhập của các vị trí xa bởi các dòng khác nhau từ khối u nguyên phát, dẫn đến di căn đa dòng. Các nghiên cứu về các mô hình di căn ung thư rắn khác nhau hỗ trợ khái niệm này bằng cách tiết lộ sự gieo hạt đa dòng và tính không đồng nhất trong các tổn thương di căn. Dòng chảy hai chiều của tế bào ung thư, như được đề xuất bởi quá trình gieo hạt tự / chéo khối u (được biểu thị bằng mũi tên màu xanh lá cây và màu cam) hoặc di căn thứ cấp từ vị trí di căn (mũi tên màu xanh lam), làm tăng thêm sự phức tạp của di căn, cho thấy sự không đồng nhất tiềm ẩn trong và giữa các bệnh nhân trong đáp ứng và kháng thuốc điều trị
Khoảng một nửa số khối u nội sọ là di căn não. Vị trí phổ biến nhất của di căn nội sọ là nhu mô não. Ngoài ra, ung thư có thể di căn đến hộp sọ, màng cứng và màng não, với di căn xảy ra đồng thời, có thể dẫn đến các biến chứng thần kinh nghiêm trọng. 13 Bằng chứng là các nghiên cứu đã được công bố, tỷ lệ di căn não dao động từ 8,3 đến 14,3 trên 100.000 cá nhân,14,15,16 với tỷ lệ hiện mắc từ 1,9% đến 9,6% ở bệnh nhân ung thư. 17,18,19 Trước đây, chẩn đoán di căn não chủ yếu phụ thuộc vào xác minh bệnh lý của các mẫu bệnh phẩm được phẫu thuật lấy ra và khám nghiệm tử thi của bệnh nhân đã chết. Tuy nhiên, xét rằng các bác sĩ phẫu thuật thần kinh thường điều trị cho những bệnh nhân di căn não khu trú và những người có tỷ lệ sống sót dự kiến lâu hơn,20 và không phải tất cả các cuộc khám nghiệm tử thi đều bao gồm kiểm tra hệ thần kinh trung ương, tỷ lệ di căn não có lẽ đã bị đánh giá thấp. 13,17 Hiệu quả của hóa trị trong việc kéo dài thời gian sống sót21,22,23 đã làm tăng khả năng tế bào ung thư lây lan đến não. Hơn nữa, sự tiến bộ liên tục trong công nghệ hình ảnh đã cải thiện khả năng phát hiện, góp phần làm tăng tỷ lệ di căn não. 13,21
Dữ liệu thống kê chỉ ra rằng hơn 19 triệu trường hợp ung thư mới được đăng ký trên toàn thế giới hàng năm, với hơn 60% trong số này cuối cùng phát triển thành bệnh di căn. 24,25 Di căn xương chiếm một tỷ lệ đáng kể trong các trường hợp này. Đáng chú ý là tỷ lệ di căn xương ở bệnh nhân ung thư vú, tuyến tiền liệt và phổi lần lượt cao tới 75, 70–85 và 40%. 26,27,28,29 Di căn xương ảnh hưởng đến sức khỏe của xương và thường dẫn đến các biến chứng nghiêm trọng, bao gồm các biến cố liên quan đến xương (SRE), chẳng hạn như gãy xương và tăng đau. Những biến chứng này có tác động có hại rõ rệt đến chất lượng cuộc sống của bệnh nhân và làm tăng đáng kể gánh nặng y tế tổng thể. 30,31 Ở những bệnh nhân ung thư tuyến tiền liệt, tỷ lệ sống sót trong ba năm và năm năm lần lượt là 50 và 65%, ở những bệnh nhân có di căn xương so với những người không có, điều này cho thấy tác động bất lợi của di căn xương đối với tỷ lệ sống sót của bệnh nhân ung thư. 32 Hơn nữa, ở những bệnh nhân ung thư phổi và di căn xương, tỷ lệ mắc SRE trong vòng một năm sau khi chẩn đoán cao tới 55%, dẫn đến tỷ lệ sống sót giảm đáng kể. 33
Di căn gan là một biến chứng phổ biến ở giai đoạn tiến triển của các bệnh ung thư khác nhau, ảnh hưởng đến khoảng 5% bệnh nhân ung thư. Nó phổ biến đáng chú ý ở phụ nữ trẻ bị ung thư vú và nam thanh niên bị ung thư đại trực tràng. 34 Tuy nhiên, với tuổi tác ngày càng tăng, các loại ung thư nguyên phát gây di căn gan trở nên đa dạng, vượt ra ngoài ung thư phổi, tuyến tụy và đại trực tràng bao gồm ung thư thực quản, dạ dày và ruột non. 35,36,37,38 Cấu trúc và chức năng sinh lý đặc biệt của gan khiến nó trở thành “thiên đường” cho nhiều tế bào khối u,10,39 góp phần làm tăng tỷ lệ di căn gan ở các quốc gia như Hoa Kỳ so với ung thư gan nguyên phát. 40,41 Đáng chú ý, tỷ lệ sống sót của bệnh nhân di căn gan thấp hơn rõ rệt, với tỷ lệ sống sót một năm chỉ là 15,1%, thấp hơn đáng kể so với 24,0% quan sát thấy ở những bệnh nhân không di căn gan. 34 Hơn nữa, việc tiêu thụ các nguồn lực y tế trở nên trầm trọng hơn do di căn gan, do đó gây ra gánh nặng kinh tế và tâm lý đáng kể cho gia đình bệnh nhân và xã hội.
Tỷ lệ di căn phổi cao tới 17,92 trên 100.000 người42 và thường xảy ra trong các bệnh ung thư như ung thư phổi và ung thư đại trực tràng. 43,44,45 Khoảng 4% bệnh nhân ung thư có biểu hiện di căn phổi đồng bộ tại thời điểm chẩn đoán. 42 Trong số các bệnh nhân ung thư phổi nguyên phát, tỷ lệ bệnh nhân di căn phổi cao tới 13%. Ngược lại, tỷ lệ này thấp nhất ở bệnh nhân ung thư tuyến tiền liệt, chỉ 0,5%, với tỷ lệ này liên tục tăng. 42 Hiện tượng này có thể liên quan chặt chẽ đến việc sử dụng rộng rãi các công nghệ hình ảnh tiên tiến, chẳng hạn như CT và PET, tạo điều kiện phát hiện di căn phổi chính xác hơn. 46 Tuy nhiên, tiên lượng của bệnh nhân di căn phổi nói chung là xấu, với tỷ lệ sống sót tổng thể thấp hơn đáng kể so với bệnh nhân không di căn phổi. Nhóm này chủ yếu bao gồm nam giới cao tuổi bị ung thư giai đoạn cuối42]. Do đó, việc cải thiện tầm soát sớm, chẩn đoán chính xác và điều trị toàn diện cho nhóm có nguy cơ cao này là bắt buộc.
Cơ chế di căn ung thư
Lý thuyết tropism và di căn cơ quan
Di căn là một đặc điểm xác định của bệnh ác tính gây ra những thách thức đáng kể trong ung thư, do sự lây lan của tế bào ung thư từ các vị trí chính đến các cơ quan ở xa. Các tế bào di căn thường thể hiện các sở thích cụ thể của các cơ quan, được gọi là “cảm dục cơ quan”. Xác định khuynh hướng này là rất quan trọng để thúc đẩy các biện pháp phòng ngừa và điều trị. Hai lý thuyết then chốt, giả thuyết “hạt giống và đất” và lý thuyết “di căn đa dòng”, nâng cao hiểu biết của chúng ta về tính nhiệt huyết của xương. Được Paget giới thiệu vào năm 1889, giả thuyết “hạt giống và đất” cho rằng di căn không phải là ngẫu nhiên. 47 Nó đề xuất rằng “hạt giống” (tế bào ung thư) cần một “đất” thuận lợi (vị trí di căn) để phát triển thành công, với các hốc mô cụ thể cung cấp các yếu tố tạo điều kiện cho sự phát triển của chúng. Hơn nữa, nguồn gốc của các tế bào di căn không giới hạn ở hoạt động của một “hạt giống” trội đơn lẻ. Thay vào đó, đó là sự đóng góp tập thể của các quần thể tế bào ung thư khác nhau trong khối u nguyên phát, được gọi là “di căn đa dòng”, điều phối quá trình di căn này. 48 Điều này nhấn mạnh sự không đồng nhất vốn có trong các khối u nguyên phát, điều này rất quan trọng đối với khả năng di căn của chúng.
Lý thuyết hạt giống và đất
Lý thuyết “hạt giống và đất” cung cấp một khuôn khổ để hiểu quá trình phức tạp của di căn ung thư. Sự lây lan thành công của các tế bào ung thư (“hạt giống”) đến các cơ quan hoặc mô xa phụ thuộc vào cả đặc tính nội tại của chúng và vi môi trường thuộc địa xa (“đất”). Di căn xảy ra khi các tế bào khối u tuần hoàn (CTC) tương tác với vi môi trường của một cơ quan ở xa, tạo điều kiện thuận lợi cho sự tồn tại, tăng sinh và xâm chiếm của chúng. 49 Sau khi tách ra khỏi khối u nguyên phát, CTC xâm nhập vào máu và phải sống sót trong môi trường thù địch, trốn tránh sự giám sát miễn dịch, bám vào các mao mạch hẹp của các cơ quan ở xa và tràn vào mô xung quanh. Bước ngoài mạch này đặc biệt quan trọng đối với cảm giác hướng nội tạng, vì nó xác định liệu các tế bào ung thư có thể thiết lập một hốc trong các cơ quan mục tiêu cụ thể hay không (Hình E). 2). Chúng tôi đã tóm tắt các phân tử và con đường tín hiệu chính được báo cáo về tính hướng cơ quan trong Bảng 2.
Quan trọng không kém là “đất”, hoặc môi trường vi mô tại vị trí di căn. Môi trường này bao gồm một loạt các yếu tố tăng trưởng, cytokine và các thành phần ma trận ngoại bào phức tạp và các loại tế bào đa dạng (Bảng 2). Tế bào ung thư, hốc mô cụ thể và tế bào miễn dịch tham gia vào giao tiếp tế bào chuyên sâu để định hình hệ sinh thái thuận lợi cho khối u. Cấu trúc mô cũng ảnh hưởng đến các mô hình di căn; Ví dụ, hệ thống bạch huyết thường đóng vai trò là con đường chính để lan truyền, với các hạch bạch huyết cung cấp các vị trí ban đầu để bẫy và tăng sinh tế bào ung thư trước khi lây lan thêm qua hệ thống bạch huyết và tuần hoàn. 50 Tương tự như vậy, gan và phổi là những vị trí di căn phổ biến do mô hình lưu lượng máu đặc biệt của chúng. 51,52 Những hiểu biết này nhấn mạnh sự tương tác phức tạp giữa cấu trúc di truyền của tế bào ung thư và môi trường vi mô xa xôi cho phép. Nhận ra những động lực “hạt giống và đất” này có thể hướng dẫn sự phát triển của các chiến lược điều trị hiệu quả hơn nhằm phá vỡ các hốc hỗ trợ và cản trở sự xâm nhập và phát triển của các tế bào ung thư di căn. Nghiên cứu tiếp tục sẽ nâng cao hiểu biết của chúng ta về di căn xương và cung cấp thông tin cải thiện việc quản lý các bệnh ung thư khác nhau.
Các mô hình lưu thông máu và bạch huyết đóng một vai trò quan trọng trong việc xác định các vị trí di căn. Các yếu tố giải phẫu ảnh hưởng lớn đến vị trí mà tế bào ung thư lan tỏa, với gan và phổi là những vị trí di căn phổ biến do mô hình lưu lượng máu đặc biệt của chúng. 51,52 Ví dụ, ung thư đường tiêu hóa thường di căn đến gan do lưu lượng máu trực tiếp từ ruột qua hệ thống tĩnh mạch cửa. 53 Ngoài ra, các phân tử kết dính như integrin và selectin được biểu hiện trên bề mặt tế bào ung thư cho phép các tế bào này bám dính và xâm lấn các cơ quan mục tiêu bằng cách liên kết với các tế bào nội mô. 54 Tropism cơ quan qua trung gian integrin đã được minh họa trong các hệ thống mô hình khác nhau. Ví dụ, các nghiên cứu sử dụng khối u ác tính và tế bào ung thư vú MDA-MB-231 có nguồn gốc từ bệnh nhân55 đã chỉ ra rằng các exosome mang α6β1 và α6β4 ưu tiên di căn trực tiếp đến phổi, trong khi exosome mang αvβ5 tạo điều kiện cho quá trình xâm nhập gan. Trong ung thư vú, exosome mang β3 integrin và n-glycans / integrin sialylated có liên quan đến việc thúc đẩy di căn não. 56 Hơn nữa, αv integrin đã được chứng minh là thúc đẩy sự xâm nhập của xương bằng cách tương tác và làm rối loạn các chức năng tế bào hủy xương. 57,58,59,60 Nó đã được chọn cho các mục tiêu tiềm năng trong điều trị di căn xương. 61
Ảnh hưởng của các yếu tố hóa học và các thụ thể của chúng đối với cảm dục cơ quan là rất quan trọng trong quá trình này. Các cơ quan cụ thể tiết ra chemokin và các yếu tố tăng trưởng thu hút tế bào ung thư biểu hiện các thụ thể tương ứng của chúng. Ví dụ, trục CXCL12 / CXCR4 đóng một vai trò quan trọng trong sự di căn của ung thư vú đến phổi và xương bằng cách hướng các tế bào ung thư đến các vị trí này. 62
Thành phần của ECM trong các cơ quan khác nhau có thể ảnh hưởng đến quá trình xâm chiếm di căn. Các thành phần ECM cụ thể cung cấp một ngách hỗ trợ cho các tế bào ung thư di căn, tạo điều kiện cho sự phát triển và tồn tại của chúng. Protein ECM, chẳng hạn như fibronectin và laminin, tăng cường khả năng bám dính và xâm lấn của tế bào ung thư. 63
Sự hình thành một hốc tiền di căn (PMN) được bắt đầu bởi các yếu tố tiết ra khối u, chuẩn bị các cơ quan xa cho các tế bào ung thư ngay cả trước khi chúng đến. Exosome, cytokine và các thành phần phân tử khác do khối u nguyên phát tiết ra có thể thay đổi vi môi trường của các cơ quan đích để hỗ trợ di căn. Một yếu tố quan trọng khác trong di căn ung thư là trốn tránh miễn dịch, theo đó các tế bào ung thư tránh được sự phát hiện và phá hủy của hệ thống miễn dịch để xâm chiếm các vị trí mới. 64 Ví dụ, một số cơ quan, chẳng hạn như não, cung cấp một môi trường miễn dịch đặc biệt để bảo vệ các tế bào di căn khỏi sự giám sát miễn dịch. 65 Cuối cùng, các yếu tố tăng trưởng đặc hiệu của cơ quan hỗ trợ sự phát triển của các tế bào di căn. Các cơ quan cụ thể tạo ra các yếu tố tăng trưởng có lợi cho sự tăng sinh của các loại ung thư cụ thể. Ví dụ, IGF-1 trong tủy xương hỗ trợ di căn ung thư tuyến tiền liệt. 66
Di căn đa dòng
Lý thuyết “di căn đa dòng” nhấn mạnh rằng di căn phát sinh thông qua một quá trình tiến hóa phức tạp, năng động (Hình E). 2). Do sự không ổn định bộ gen vốn có, các tế bào khối u tích tụ nhiều đột biến, dẫn đến sự không đồng nhất đáng kể và cho phép các mô khác nhau được xâm chiếm bởi nhiều bản sao khối u khác nhau về mặt di truyền (tức là di căn đa dòng). 67 Các nghiên cứu giải trình tự toàn bộ bộ gen đã chỉ ra rằng di căn có thể bắt nguồn từ việc trộn lẫn nhiều bản sao khối u trên các vị trí di căn, làm nổi bật bản chất đa diện của sự lan tỏa di căn. 68 Khái niệm này phù hợp với động lực tiến hóa được mô tả bởi Turajlic và Swanton,69 những người đã chứng minh rằng các dòng phụ di căn mới nổi đóng góp đáng kể vào sự đa dạng di truyền trong các khối u di căn.
Các bằng chứng khác về di căn đa dòng bao gồm di căn hạch bạch huyết đa dòng trong ung thư đại trực tràng phát sinh từ các vùng khác nhau của khối u nguyên phát,70 cũng như di căn ung thư vú do sự phổ biến tập thể của các cụm tế bào khối u biểu hiện keratin 14. 71 Trong nghiên cứu TRACERx, cả di căn đa dòng và đơn dòng đều được quan sát thấy ở ung thư phổi không tế bào nhỏ (NSCLC), minh họa rằng các dòng di căn thường đại diện cho sự mở rộng của các dòng phụ từ khối u nguyên phát. 72,73 Đặc biệt, bệnh nhân ung thư đại trực tràng (CRC) thường có biểu hiện di căn đa dòng trong các hạch bạch huyết so với các cơ quan khác,74,75,76 và di căn ung thư vú ba âm tính (TNBC) thường cho thấy các quần thể phân vô tính không đồng nhất đặc trưng của việc gieo hạt đa dòng. 77 Các mô hình tương tự đã được ghi nhận trong ung thư đại trực tràng và tuyến tụy, trong đó các dòng phụ riêng biệt làm phát sinh các tổn thương di căn, củng cố hơn nữa bản chất đa dòng của di căn và tác động của nó đối với sự không đồng nhất trong điều trị. 78,79,80 Khái niệm tự gieo hạt khối u đưa ra khả năng các tế bào khối u tuần hoàn có thể tái sinh cả tổn thương nguyên phát và di căn, làm tăng tính không đồng nhất của khối u hơn nữa,81 một hiện tượng cũng được hỗ trợ bởi các nghiên cứu ung thư gan gần đây sử dụng các hệ thống ghi nhãn mới (Hình E). 2). 82
Nói chung, những hiểu biết này nhấn mạnh rằng di căn đa dòng có ý nghĩa sâu sắc đối với di căn xương và hơn thế nữa. Các dòng phụ riêng biệt có thể đáp ứng khác nhau với các can thiệp điều trị dựa trên cấu trúc di truyền độc đáo của chúng, góp phần vào các phản ứng điều trị và kháng thuốc khác nhau trong một bệnh nhân. Hiểu được cấu trúc vô tính phức tạp này là rất quan trọng để phát triển các chiến lược thực tế, có mục tiêu để kiểm soát di căn xương và cải thiện kết quả của bệnh nhân.
Tầng di căn
Di căn là một quá trình sinh học liên quan đến các tương tác phức tạp giữa các tế bào ung thư thuộc địa và vi môi trường di căn. Tại vị trí khối u nguyên phát, nguyên bào sợi liên quan đến ung thư (CAF), tế bào mô đệm và các tế bào khác thiết lập một “ngách” có lợi cho sự di căn của tế bào khối u thông qua các cơ chế điều hòa từ xa, cung cấp môi trường vi mô cần thiết cho sự di chuyển của tế bào khối u và tạo điều kiện cho sự tách ra của chúng khỏi vị trí chính và bắt tay vào hành trình xâm lấn của chúng. Khi các tế bào khối u di chuyển, chúng trốn tránh sự giám sát miễn dịch và tương tác với CAF và tế bào dòng tủy tuần hoàn để tăng cường khả năng sống sót và xâm lấn. Khi đến vị trí di căn, các tế bào khối u tràn ra ngoài thông qua các tương tác thường xuyên với vi môi trường cục bộ (Hình E). 3).
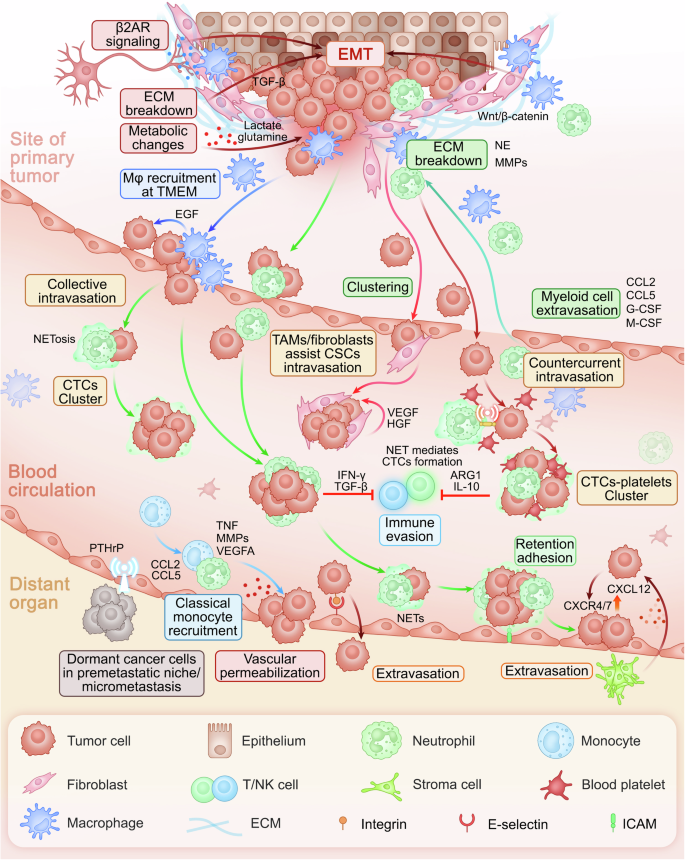
Cơ chế của dòng thác di căn ung thư. Tại các vị trí khối u nguyên phát, nguyên bào sợi liên quan đến ung thư (CAF) và tế bào mô đệm tạo ra một thị trường ngách có lợi cho di căn để hỗ trợ quá trình EMT, phổ biến và di chuyển của tế bào ung thư. Khi các tế bào ung thư di chuyển tương tác với CAF và tế bào dòng tủy tuần hoàn để tăng cường khả năng sống sót và xâm lấn trong khi trốn tránh phát hiện miễn dịch, cuối cùng chúng đến các vị trí di căn, nơi chúng chuyển từ trạng thái ngủ đông và tương tác với môi trường vi mô để bắt đầu tăng sinh tích cực. Dòng thác di căn bắt đầu bởi các tế bào khối u nguyên phát xâm lấn các mô lân cận thông qua EMT được tạo điều kiện thuận lợi bởi CAF thúc đẩy khả năng vận động và thoái hóa ECM. Hơn nữa, đại thực bào và bạch cầu trung tính liên quan đến khối u (TAN) góp phần đáng kể vào sự phân hủy ECM, tạo điều kiện cho tế bào ung thư xâm thông và sống sót trong tuần hoàn bằng cách tạo thành tập hợp với tiểu cầu và tế bào dòng tủy để tránh sự giám sát miễn dịch. Các tương tác chính giữa tế bào ung thư và nội mô tạo điều kiện cho sự kết dính và tràn máu vào tủy xương, được hỗ trợ bởi việc lập trình lại trao đổi chất của nguyên bào xương và tế bào hủy xương. Ngoài ra, các tế bào dòng tủy tăng cường khả năng sống sót và di căn của tế bào ung thư thông qua ức chế miễn dịch, hỗ trợ trao đổi chất và tái tạo ECM, bao gồm các hoạt động quan trọng của bạch cầu trung tính và đại thực bào trong việc tạo điều kiện kết dính, xâm lấn và tăng sinh di căn tế bào khối u tại các vị trí thứ cấp
Thị trường ngách tiền di căn
Sự hình thành PMN trong xương là kết quả của sự tương tác giữa các tế bào khối u nguyên phát và các tế bào ngách xa khác nhau. Những tương tác này tạo điều kiện thuận lợi cho những thay đổi phân tử và tế bào ở các cơ quan ở xa, tạo tiền đề cho việc gieo hạt di căn trước khi di căn tập thể và ồ ạt có thể phát hiện được lâm sàng. Việc thành lập PMN đặt cơ sở cho chủ nghĩa nội tạng. Ví dụ, nguyên bào sợi rất quan trọng để thiết lập một môi trường có lợi cho sự xâm nhập di căn. Tầm quan trọng của nguyên bào sợi trong việc hình thành hốc di căn được nhấn mạnh bởi vai trò thiết yếu của biểu hiện periostin trong sự tăng sinh của các tế bào gốc ung thư lan tỏa sớm tại các vị trí thứ cấp, làm nổi bật ảnh hưởng quan trọng của các tín hiệu ngách mô đệm. 83 Hơn nữa, chất nền liên quan đến khối u, bao gồm nguyên bào sợi và nguyên bào cơ, đóng một vai trò tích cực trong việc hỗ trợ sự mở rộng khối u bằng cách thúc đẩy sự hình thành mạch mới và sự tăng sinh và xâm lấn của các tế bào ung thư, do đó hỗ trợ gieo hạt xa, chẳng hạn như xâm nhập xương. 84 Các nghiên cứu về các tế bào HCC di căn cao đã chỉ ra rằng sự bài tiết của miR-1247-3p exosomal kích hoạt nguyên bào sợi và thúc đẩy di căn phổi trong ung thư gan. 85 Các túi ngoại bào tiết ra (sEV) đóng vai trò quan trọng trong việc hình thành PMN trong phổi và trong việc chuẩn bị di căn phổi và não do các bệnh ung thư khác nhau. 86 Các sEV này chứa nhiều phân tử khác nhau, bao gồm axit nucleic, protein tín hiệu, enzyme, lipid và chất chuyển hóa, có thể ảnh hưởng đến các chức năng và giao tiếp của tế bào. 87
Trong xương, sự khởi đầu của PMN được cho là do các tế bào tiền thân tạo máu dương tính với VEGFR1, di chuyển đến các vị trí cụ thể trước khi di căn và tạo thành các cụm để dự đoán sự xuất hiện của tế bào khối u, cho thấy vai trò của tủy xương trong sự khởi đầu PMN. 88 Sự tương tác giữa tế bào ung thư và tế bào gốc / tiền thân tạo máu và trung mô nằm trong hốc di căn xương tạo điều kiện giao tiếp qua lại giữa các tế bào khối u và chất nền di căn xương. 89 Trong u tủy, nguyên bào xương trải qua quá trình tái lập trình trao đổi chất để đáp ứng với khối u nguyên phát, được đặc trưng bởi tăng hấp thu glucose và tăng cường glycolysis. Sự thay đổi trao đổi chất này tạo điều kiện thuận lợi cho việc sản xuất lactate và các chất chuyển hóa khác được các tế bào ung thư sử dụng để sản xuất năng lượng. Tế bào hủy xương áp dụng trạng thái năng lượng cao, làm tăng khả năng hấp thu xương. 90
Các tế bào dòng tủy và tổ tiên của chúng trong PMN giúp thiết lập tình trạng viêm mãn tính ở các cơ quan thứ cấp, có thể là phản ứng miễn dịch đối với nhiễm trùng. 91 Viêm này làm tổn hại đến khả năng của hệ thống miễn dịch để bắt đầu phản ứng hiệu quả, do đó tạo điều kiện thuận lợi cho việc thiết lập thành công các tổn thương di căn. 92 Các khối u vú nguyên phát có thể gây ra sự huy động của các tế bào dòng tủy CD11b + đến phổi, tạo ra một vi môi trường ức chế miễn dịch làm giảm các hoạt động gây độc tế bào của tế bào NK93 và tế bào T,94 do đó thúc đẩy sự xâm nhập di căn trong phổi. Hơn nữa, các chất chuyển hóa lipid trong bạch cầu trung tính cư trú phổi đã được xác định là nguồn năng lượng quan trọng ảnh hưởng đến di căn phổi trong ung thư vú (BC). 95 Hơn nữa, sự phát triển của khối u nguyên phát và khối u BC có thể phá vỡ quá trình tạo tủy từ xa thông qua sEV, dẫn đến sự biệt hóa dòng tủy bất thường trong tủy xương, tích tụ các tế bào dòng tủy trong tủy xương và hỗ trợ sự tiến triển của khối u96,97 (Hình E). 3). Trong ung thư đại trực tràng (CRC), tế bào Kupffer có thể thực bào các exosome mang miR-135a-5p biểu hiện cao từ máu vào gan, do đó thiết lập tính hướng gan. 98 Ngoài ra, các phân tử tiết ra như chất ức chế mô của metalloproteinase (TIMP-1), 99 VEGFA, 100,101,102 và CCL15103 có thể tích tụ các tế bào dòng tủy khác nhau trong gan và tạo thành PMN trong gan.
Phổ biến tế bào ung thư và thâm máu
Dòng thác di căn bắt đầu với sự xâm lấn của các tế bào khối u nguyên phát vào các mô lân cận. Quá trình xâm lấn này thường liên quan đến quá trình chuyển đổi biểu mô-trung mô (EMT), cho phép các tế bào ung thư có được các đặc tính di cư và xâm lấn. Đồng thời, các tế bào khối u nguyên phát phá vỡ ECM và tạo ra các con đường để lan truyền. Vi môi trường khối u cục bộ (TME) hỗ trợ phân hủy EMT và ECM, cho phép xâm thông vào máu hoặc hệ thống bạch huyết (Hình E). 3).
CAF đóng nhiều vai trò trong di căn ung thư. Một cơ chế quan trọng liên quan đến cảm ứng EMT trong các tế bào khối u. CAF tiết ra các yếu tố như TGF-β, điều chỉnh giảm E-cadherin và điều chỉnh tăng N-cadherin và vimentin, biểu thị kiểu hình trung mô. 104.105.106 Sự chuyển đổi này thúc đẩy khả năng di chuyển và xâm lấn của tế bào khối u, tạo điều kiện cho chúng thoát khỏi khối u nguyên phát. Ngoài ra, CAF thúc đẩy di căn bằng cách tu sửa ECM. Hơn nữa, chúng tiết ra các metalloproteinase ma trận (MMP), làm suy giảm các thành phần ECM và giảm độ bám dính của tế bào-tế bào, hỗ trợ sự xâm lấn và di chuyển của tế bào khối u. 107 Hơn nữa, tương tác trực tiếp giữa CAF và tế bào ung thư biểu mô ảnh hưởng đến sự xâm lấn, với CAF tổ chức lại các sợi collagen trong ECM, tạo ra các con đường cho sự tiến triển của tế bào khối u. 108 Ngoài ra, CAF được mồi hỗ trợ sự xâm lấn của tế bào khối u thông qua nhiễu xuyên âm chuyển hóa bằng cách tiết ra các chất chuyển hóa như lactate và glutamine, mà tế bào ung thư dễ dàng sử dụng, cung cấp năng lượng cho các con đường tăng cường khả năng xâm lấn của chúng. 109.110 Hơn nữa, những thay đổi trao đổi chất này không chỉ thúc đẩy sự phát triển và di căn của khối u nguyên phát mà còn thúc đẩy sự trốn tránh miễn dịch bằng cách tăng đường phân (hiệu ứng Warburg111), ức chế phản ứng chống khối u của tế bào NK,112 làm suy giảm kích thích tiền viêm đại thực bào,113 rối loạn điều hòa chức năng tế bào tủy,114,115 hạn chế biểu hiện kháng nguyên tế bào đuôi gai,116 và thúc đẩy sự xâm nhập tế bào T điều hòa. 117
Ngoài CAF, bạch cầu trung tính liên quan đến khối u (TAN) và đại thực bào liên quan đến khối u (TAM) hỗ trợ sự xâm lấn ung thư thông qua sự thoái hóa ECM thông qua bài tiết MMP.118 Ngoài ra, chúng tiết ra osteonectin, thúc đẩy các tế bào khối u và tương tác ECM. 119 Việc tái tạo ECM hơn nữa được thúc đẩy bởi các yếu tố có nguồn gốc từ TAM và Tan như elastase, cathepsin và proteinase-3. 120.121 Những thay đổi trong vi môi trường xương thúc đẩy quá trình xâm lấn. Tái lập trình trao đổi chất, kèm theo giải phóng chất chuyển hóa trong quá trình phân hủy xương qua trung gian tế bào hoại xương, tạo ra một môi trường có tính axit cao. Nhiễm toan này kích hoạt các protease, chẳng hạn như cathepsin K, thúc đẩy sự thoái hóa ECM và tạo điều kiện thuận lợi cho các bước đầu của quá trình phân ly và xâm lấn tế bào khối u. 122
Vi môi trường khối u để di căn (TMEM) là một yếu tố dự đoán mạnh mẽ về di căn ở BC người. Sự hình thành Invadopodia, được thúc đẩy bởi sự tương tác giữa đại thực bào và tế bào khối u, là chìa khóa cho sự xâm thông tế bào khối u trong TMEM. 123.124.125 Một vòng paracrine liên quan đến các yếu tố tăng trưởng có nguồn gốc từ đại thực bào và yếu tố kích thích khuẩn lạc do tế bào khối u tạo ra 1 thúc đẩy các tương tác này. Ngoài ra, tính thấm mạch máu thoáng qua trong TMEM tạo điều kiện cho tế bào khối u thoát ra tuần hoàn. Tế bào gốc ung thư (CSC) tích tụ tại các vị trí TMEM gần TAM. Khả năng di chuyển vốn có thấp hơn của chúng cho thấy CSC có thể xâm thông một cách hiệu quả bằng cách khai thác các kết nối đại thực bào-nội mô. 126.127
Trong mô hình BC biểu hiện quá mức kháng nguyên T giữa polyomavirus, TAM thúc đẩy quá trình xâm thông tế bào ung thư bằng cách một phần gây ra sự hình thành mạch thông qua bài tiết VEGFA, do đó làm tăng mật độ mạch máu. 128 Ngoài ra, một tập hợp con của Tie2+ TAM chuyển hóa thành các đại thực bào quanh mạch thúc đẩy rò rỉ mạch máu và trực tiếp tạo điều kiện thuận lợi cho sự xâm thông của các tế bào khối u. 129.130.131 TANs cũng thúc đẩy sự xâm nhập của tế bào khối u nhưng thông qua các quá trình khác nhau. Một giả thuyết cho rằng bạch cầu trung tính di chuyển tạo ra các đường hầm trong ECM, cho phép các tế bào khối u lan tỏa vào hệ mạch. Hơn nữa, các tế bào khối u có thể bám trực tiếp vào bạch cầu trung tính, sử dụng chúng để tạo điều kiện thuận lợi cho việc vận chuyển qua nội mô132,133 (Hình E). 3).
Lưu thông tế bào ung thư
Hệ tuần hoàn có một môi trường khắc nghiệt, gây ra nhiều trở ngại đối với sự phát triển của tế bào khối u. Tuy nhiên, hầu hết các tế bào khối u là Ki67+, cho thấy chúng đang ở trạng thái tăng sinh tích cực. CTC đã phát triển các chiến lược để tránh giám sát miễn dịch để tồn tại và cuối cùng di căn. Ngày càng có nhiều nghiên cứu làm sáng tỏ các cơ chế này, làm nổi bật cách CTC trốn tránh sự phát hiện và tồn tại khi chúng di chuyển đến các vùng xương xa xôi (Hình E). 3).
Một cơ chế quan trọng liên quan đến việc che giấu vật lý trong các tập hợp tiểu cầu, che khuất chúng khỏi sự giám sát miễn dịch. 134 Cả selectin và integrin đều tạo điều kiện thuận lợi cho sự tương tác này. Ngoài việc che chắn vật lý, tiểu cầu giải phóng các yếu tố tín hiệu gây ra EMT trong CTC, thúc đẩy tính xâm lấn, thân cây, khả năng vận động và khả năng chống lại anoikis. 135 CAF cũng có thể đi kèm với CTC trong tuần hoàn, hỗ trợ chúng theo nhiều cách. MMP tiết ra CAF làm suy giảm các rào cản vật lý, trong khi các yếu tố tăng trưởng, chẳng hạn như yếu tố tăng trưởng nội mô mạch máu (VEGF) và yếu tố tăng trưởng tế bào gan (HGF), hỗ trợ sự sống sót của CTC. Hơn nữa, CAF tạo điều kiện thuận lợi cho khả năng thích ứng trao đổi chất cần thiết cho CTC để chịu được căng thẳng trong quá trình lưu thông. 136.137
Các tế bào dòng tủy cũng hỗ trợ CTC, thường tạo thành các tập hợp tế bào với các tế bào khối u lan tỏa. Các nghiên cứu ban đầu trong ống nghiệm đã chỉ ra rằng TANs thúc đẩy sự kết hợp của cả tế bào vú và CRC. Sau đó, bẫy ngoại bào bạch cầu trung tính (NET) có liên quan đến sự xuất hiện của huyết khối tĩnh mạch trong phổi. 138 Điều tra sâu hơn cho thấy các CTC liên quan đến bạch cầu trung tính, cả trong mô hình khối u vú 4T1 và ở bệnh nhân BC, cho thấy hồ sơ biểu hiện gen tiền khối u được đặc trưng bởi sự làm giàu của các chất điều hòa tích cực của sự tiến triển chu kỳ tế bào và sao chép DNA. Kiểu hình tiền khối u này góp phần tăng cường khả năng di căn. Phù hợp với những quan sát này, sử dụng kháng thể để ngăn chặn bạch cầu trung tính làm giảm tỷ lệ di căn xương. Ngược lại, sự điều chỉnh tăng của yếu tố kích thích tế bào hạt làm tăng cường sự tập hợp của TANs và CTC, do đó làm trầm trọng thêm tình trạng di căn. 139
Bạch cầu trung tính đóng vai trò kép trong việc bảo vệ CTC trong quá trình giám sát miễn dịch ở bệnh nhân BC. Chúng ức chế khả năng đáp ứng của các tế bào tiêu diệt tự nhiên (NK) bằng cách làm giảm tín hiệu thông qua các thụ thể bề mặt tế bào. 140 Hơn nữa, bạch cầu trung tính bảo vệ các tế bào khối u khỏi các phản ứng của tế bào T chống khối u. Sự gia tăng bạch cầu trung tính ức chế tế bào T đã được quan sát thấy một cách toàn thân trong các mô hình khối u vú. 141 bạch cầu trung tính có nguồn gốc từ bệnh nhân ung thư hắc tố và ung thư biểu mô tế bào thận có mức độ ARG1 tăng cao, một loại enzyme ức chế các phản ứng gây độc tế bào qua trung gian tế bào T. Sự suy giảm bạch cầu trung tính phục hồi sự tăng sinh tế bào T gây độc tế bào. 142.143 Hơn nữa, những phát hiện gần đây cho thấy một cơ chế hợp tác trong đó CTC kích hoạt tiểu cầu và bạch cầu trung tính thông qua tương tác tế bào trực tiếp, tạo ra một mạng lưới bảo vệ trong hệ mạch. 144 Sự kích hoạt lẫn nhau này tạo điều kiện thuận lợi cho việc tập hợp các tế bào khối u lan tỏa với bạch cầu trung tính và tiểu cầu và có khả năng bảo vệ CTC khỏi sự phá hủy cơ học và qua trung gian miễn dịch trong quá trình di căn (Hình E). 3).
Tế bào ung thư tràn máu và gieo hạt trong mô xa
Bên cạnh việc tồn tại trong tuần hoàn, CTC phải điều hướng một số bước để thiết lập các khuẩn lạc ở các cơ quan ở xa. Chúng bao gồm sự kết dính và di chuyển qua nội mô, thoái hóa ECM, xâm lấn nhu mô. Tương tác ban đầu giữa CTC và nội mô rất quan trọng trong hốc di căn. Các selectin nội mô, chẳng hạn như E-selectin, tạo điều kiện cho việc kết nối CTC và lăn qua các tương tác phối tử-thụ thể. 145 Độ bám dính được ổn định hơn nữa bởi các cặp integrin cụ thể, đáng chú ý là integrin αvβ3, trên CTC và phối tử nội mô của chúng. 146.147.148
Độ bám dính là bước sơ bộ quan trọng khi CTC xâm lấn các mô. Cho rằng các mô khác nhau có môi trường cân bằng nội môi riêng biệt, CTC sử dụng các chiến lược khác nhau, mỗi chiến lược thích ứng với các điều kiện cụ thể của mô được đề cập, để đảm bảo quá trình thoát khí và gieo hạt thành công. Quá trình này đòi hỏi các tương tác phân tử đặc biệt và thích nghi với môi trường vi mô đặc biệt của các mô đích, do đó đảm bảo sự xâm nhập và tăng trưởng hiệu quả. Bởi vì xương đại diện cho một cơ quan chính thường là mục tiêu của vô số các bệnh ung thư, cuộc thảo luận này sẽ tập trung vào việc giải thích chi tiết về hiện tượng di căn xương trong các mô khác nhau.
Tín hiệu chemokine qua trục CXCL12-CXCR4 hướng CTC đến các vị trí xương giàu CXCL12. 149.150 Sau khi gắn vào nội mô, CTC phải xuyên qua hàng rào mạch máu để đến tủy xương, tiết ra VEGF để tăng tính thấm của mạch máu và hỗ trợ hành trình xuyên nội mô của chúng. 151 Tương tác với các tế bào niêm mạc mạch máu, bao gồm cả tế bào ngoại ly, có thể tạo điều kiện thuận lợi hoặc cản trở quá trình thoát khí CTC152 (Hình E). 3).
Trong vi môi trường xương, mạng lưới tế bào mô đệm ảnh hưởng đáng kể đến tiềm năng di căn CTC. Nguyên bào xương phát ra chất thu hút hóa học, chẳng hạn như chất kích hoạt thụ thể của phối tử yếu tố hạt nhân-κB (RANKL), thu hút các CTC biểu hiện thụ thể RANK đến hốc xương. 153 CTC điều khiển tái tạo xương bằng cách tạo ra tế bào hủy xương thông qua bài tiết protein liên quan đến hormone tuyến cận giáp (PTHrP) và giải phóng các cytokine và các yếu tố tăng trưởng từ ma trận xương để tạo ra một môi trường nuôi dưỡng cho sự tăng sinh CTC. 154 Một số CTC có thể chuyển sang trạng thái ngủ đông trong xương và được kích hoạt lại trong điều kiện thuận lợi. 155.156.157.158
Tăng cường phosphoryl hóa oxy hóa trong đại thực bào có liên quan đến việc bài tiết các yếu tố tiền khối u, hỗ trợ sự sống sót của tế bào khối u và EMT thông qua các con đường như tín hiệu Wnt / β-catenin tại các vị trí di căn. 159.160.161 Bạch cầu trung tính đồng khu trú với các tế bào khối u tại các vị trí di căn, tạo điều kiện cho sự kết dính và ngừng của chúng, đặc biệt là ở phổi và gan, do đó thúc đẩy sự lưu giữ của các tế bào khối u. 162.163 Các nghiên cứu về các khối u vú hung hãn và mẫu TNBC đã cho thấy NET có nguồn gốc từ bạch cầu trung tính tăng cao trong phổi. 164 NETosis tăng cường sự kết dính của tế bào khối u với các lớp đơn bạch cầu trung tính, một quá trình được giảm thiểu bằng cách ức chế sự hình thành NET. NET bao bọc các tế bào khối u bám dính, bẫy chúng ở các vị trí xa và tương quan với gánh nặng di căn tăng lên, trong khi ức chế NET làm giảm di căn trong cơ thể. 164.165.166 Hơn nữa, sự di chuyển qua nội mô của CTC được trung gian bởi bạch cầu trung tính MMP8 / 9, với sự ức chế hoặc cắt bỏ di truyền của các enzym này, do đó làm giảm gánh nặng di căn trong các mô hình chuột140 (Hình E). 3).
Trong miễn dịch học khối u, bạch cầu đơn nhân được phân loại là tiền khối u, cổ điển, chống khối u và không cổ điển. Các bạch cầu đơn nhân cổ điển tăng cường khả năng xâm lấn của tế bào ung thư, bằng chứng là đồng nuôi cấy của chúng với các tế bào BC ở người, dẫn đến tăng sản xuất MMP9, TNF và yếu tố tăng trưởng. 167 Các tế bào khối u không hoạt động tích cực tuyển dụng bạch cầu đơn nhân tuần hoàn, tạo điều kiện thuận lợi cho quá trình thoát mạch. Tuyển dụng bạch cầu đơn nhân Ly6C+ được thúc đẩy bởi bài tiết CCL2, thúc đẩy sự tràn máu tế bào BC vào mô phổi thông qua VEGFA và MMP9. 168 Tương tự, các dòng dòng tủy Gr-1 + CD11b + góp phần giải phóng MMP9, phá vỡ các lớp đơn nội mô và tăng cường tính thấm của mạch máu. 169 Nhìn chung, những nghiên cứu này nhấn mạnh vai trò của bạch cầu trung tính và bạch cầu đơn nhân cổ điển trong việc điều chỉnh tính thấm nội mô, tạo điều kiện cho tế bào ung thư tràn dịch và xâm nhập xương (Hình E). 3).
Ung thư di căn ngủ đông, tái kích hoạt và phát triển
Ngủ đông và tái kích hoạt ung thư di căn là các quá trình phức tạp trong môi trường vi mô di căn. Các tế bào khối u lan tỏa tương tác động với các tế bào mô đệm cục bộ, quan trọng để chuyển đổi các tế bào khối u từ trạng thái ngủ đông sang tăng sinh di căn tích cực.
Việc duy trì trạng thái ngủ đông trong các tế bào di căn phụ thuộc vào một số cơ chế. Tương tác với ECM, bao gồm fibronectin, 170 tenascin C và periostin, 171 rất quan trọng đối với sự sống còn, với các phân tử kết dính, chẳng hạn như integrin, đóng một vai trò then chốt. Việc duy trì trạng thái ngủ đông được tạo điều kiện thuận lợi bởi các con đường tín hiệu căng thẳng, bao gồm p38 MAPK và phản ứng protein không mở ra. 172 Các tình trạng thiếu oxy và các con đường tín hiệu liên quan của chúng cũng góp phần duy trì sự tĩnh lặng của tế bào. Hơn nữa, các tế bào không hoạt động có thể trốn tránh sự phát hiện miễn dịch, cho phép chúng tồn tại ở trạng thái không tăng sinh. Các cơ chế tích hợp này tạo điều kiện cho sự tồn tại của các tế bào không hoạt động ở trạng thái ổn định cho đến khi các điều kiện thuận lợi cho việc tái kích hoạt và tăng trưởng173,174,175,176 (Hình E). 3).
Trong các mô hình ung thư vú và ung thư tuyến tiền liệt, viêm toàn thân kéo dài gây ra thâm nhiễm bạch cầu trung tính và hình thành NET tại các vị trí di căn. NET, bằng cách tái tạo thành phần ECM laminin, kích hoạt một dòng thác liên quan đến tín hiệu WNT, tín hiệu tích hợp và các con đường FAK / ERK / MLCK / YAP, đánh thức các tế bào khối u không hoạt động, do đó thúc đẩy sự tăng sinh của chúng. 177.178.179.180.181 Ngoài ra, viêm mãn tính làm tăng các loại oxy phản ứng và thúc đẩy quá trình hình thành mạch, phá vỡ trạng thái ngủ đông. 178.179.180 Sự tích tụ bạch cầu trung tính trong phổi trước sự xâm lấn tế bào khối u đáng kể và sự nhiễu loạn toàn thân trong quá trình tạo tủy là rõ ràng ở cả mô hình chuột và BC người. 96 Trong khối u ác tính, các yếu tố ức chế sự di chuyển của đại thực bào kích thích các tế bào Kupffer tiết ra TGF-β, thu hút các đại thực bào có nguồn gốc từ tủy xương và làm tăng nồng độ fibronectin trong gan, nhấn mạnh vai trò quan trọng của các tế bào dòng tủy cư trú trong di căn. 182 Trong các khối u vú, dòng tủy của khối u nguyên phát ảnh hưởng đến các hốc trước di căn ở xa, nơi CCL2 có nguồn gốc từ khối u thúc đẩy sự tích tụ TAM và tăng bài tiết IL1β, do đó tạo điều kiện thuận lợi cho ức chế miễn dịch tại các vị trí di căn. 183.184
Đại thực bào liên quan đến di căn (MAM) gần đây đã được xác định là các quần thể đại thực bào riêng biệt và là những người đóng vai trò quan trọng trong quá trình di căn tạo điều kiện cho sự tăng sinh của các tế bào di căn. Việc giảm sự phát triển di căn sau khi cạn kiệt đại thực bào làm nổi bật vai trò quan trọng của đại thực bào trong di căn. 185 MAM thúc đẩy sự sống sót của tế bào di căn bằng cách kích hoạt con đường Akt, cung cấp khả năng kháng các cytokine pro-apoptotic. Hơn nữa, MAM tương tác với CTC thông qua các tích hợp như phân tử kết dính tế bào mạch máu-1 (VCAM-1) để tạo thành các cụm bảo vệ giúp cải thiện tỷ lệ sống sót của tế bào ung thư trong quá trình di chuyển. 186 Tế bào đơn nhân Gr-1 + CD11b + thúc đẩy sự hình thành các tế bào khối u di căn trong phổi, đặc biệt là ở chuột mang khối u vú, thông qua các cơ chế như hình thành mạch do PDGF-BB gây ra và sản xuất CCL9,187 hỗ trợ sự sống sót của tế bào khối u188 (Hình E). 3).
Cơ chế của cảm dục cơ quan
Các mô hình biến thể bộ gen và biểu sinh riêng biệt được quan sát thấy trên các loại khối u khác nhau và các loại phụ của chúng, các phân tử cụ thể được biểu hiện bởi các tế bào khối u và các tương tác phức tạp giữa các tế bào này và môi trường vi mô cơ quan di căn tạo thành một khuôn khổ cơ bản để hiểu cơ chế hướng cơ quan189,190 (Bảng 2). Mạng lưới phức tạp và tinh vi này cung cấp một số mục tiêu tiềm năng để phát triển các chiến lược điều trị nhắm mục tiêu. 191
Di căn xương
Xương là vị trí ưu tiên cho di căn trong một số loại ung thư, có liên quan chặt chẽ đến vi môi trường độc đáo trong xương, bao gồm mạch máu cao, tình trạng thiếu oxy và nồng độ canxi cục bộ cao. 24.192.193 Xu hướng di căn xương chủ yếu ảnh hưởng đến xương trục, chẳng hạn như cột sống, xương chậu và xương sườn, chứ không phải xương xa, chẳng hạn như xương được tìm thấy ở tứ chi, có liên quan đáng kể đến sự phân bố của tủy xương đỏ. 194.195 Cấu hình hình sin đặc biệt của hệ thống mạch xương mang lại cho xương khả năng tiếp cận CTC được nâng cao, do đó thiết lập chúng là mục tiêu chính cho quá trình xâm chiếm di căn. 11 Hơn nữa, xương thể hiện một vi môi trường thiếu oxy rõ rệt, với sức căng oxy phổ biến thường giảm xuống dưới 2%. 196 Vi môi trường thiếu oxy này gây ra sự kích hoạt tín hiệu yếu tố gây thiếu oxy (HIF) trong các khối u, do đó kích hoạt một loạt các sự kiện, bao gồm EMT, xâm lấn tế bào và hình thành mạch. Các quá trình này tạo điều kiện thuận lợi cho sự xâm nhập, di căn và xâm nhập của các tế bào khối u trong xương. 197 Phân tích các mẫu ung thư vú nguyên phát từ di căn xương đã liên tục chứng minh sự gia tăng biểu hiện của HIF, làm nổi bật vai trò quan trọng của tình trạng thiếu oxy trong việc thúc đẩy cảm ứng cơ quan. 198 Trong mô xương, nồng độ canxi thường dao động từ 2 đến 4 mmol/L, trong khi ở các vùng tái tạo tích cực, chúng có thể đạt nồng độ 8–40 mmol/L.199 Nồng độ canxi cục bộ tăng cao có thể kích hoạt các thụ thể cảm nhận canxi (CaSR) trong tế bào ung thư, có khả năng khuếch đại tăng sinh, tăng cường khả năng di cư và làm cùn các tín hiệu apoptotic. 200 Một thuộc tính đặc biệt của CaSR trong các tế bào ác tính là nghiêng của nó đối với protein Gαs, một sai lệch dẫn đến sản xuất cAMP và PTHrP, thúc đẩy hơn nữa sự tiến triển và lan tỏa của khối u. 201.202.203
Khái niệm “PMN” rất quan trọng để hiểu cách các vị trí thứ cấp cụ thể trở thành vị trí ưa thích cho di căn ung thư. Trong bối cảnh TNBC, vi môi trường xương được làm giàu đáng kể với CXCL12 (còn được gọi là SDF-1) và yếu tố tăng trưởng giống insulin 1 (IGF-1), được tiết ra bởi CAF. Các cytokine này điều khiển có chọn lọc sự di căn nhiệt đới xương của các tế bào ung thư thể hiện hoạt động Src tăng cao thông qua kích thích con đường PI3K-Akt, điều này rất quan trọng trong việc điều chỉnh sự sống sót và khả năng vận động của tế bào. 204 SCUBE2, một glycoprotein tiết ra từ khối u, là một chất hỗ trợ quan trọng cho sự di căn xương trong ung thư vú luminal, đặc biệt là trong giai đoạn đầu của sự hình thành ngách. 205 SCUBE2 gián tiếp ức chế tín hiệu thụ thể giống Ig 1 (LAIR1) liên quan đến bạch cầu, làm suy giảm chức năng tế bào NK và thúc đẩy sự tồn tại và phát triển của tế bào khối u trong xương. Exosome là các túi kích thước nano do các tế bào khối u tiết ra đóng vai trò là chất giao tiếp quan trọng giữa các tế bào ung thư và các hốc trước khi di căn, thể hiện sự ưa thích đối với các cơ quan gia đình biểu hiện phối tử cùng gốc. 55 Khi tham gia, microRNA exosome (miRNA) có thể điều chỉnh biểu hiện gen trong các tế bào đích, do đó thiết kế một môi trường vi mô hiếu khách có lợi cho sự neo đậu và tăng sinh của các tế bào khối u. 206.207 Hơn nữa, yếu tố biệt hóa tăng trưởng 15 (GDF15), được tiết ra bởi các tế bào ung thư tuyến tiền liệt, cũng đã được xác định là một yếu tố góp phần làm tăng xu hướng di căn xương, như đã được chứng minh trong các mô hình xenograft tiền lâm sàng. 208
Xu hướng di căn xương có liên quan chặt chẽ đến một vòng luẩn quẩn liên quan đến các tế bào khối u và tế bào hủy xương. 209 Tế bào khối u tiết ra các chất tiêu xương, bao gồm PTHrP, IL-11 và Jagged 1, gây ra sự hấp thu xương. Những chất tiết này kích hoạt các con đường RANK / RANKL và Notch, kích thích quá trình sinh và kích hoạt chất hủy xương xương, làm trầm trọng thêm sự phá hủy xương và cung cấp một môi trường thuận lợi cho sự phát triển di căn. 154.210.211 Tiêu xương trong xương di căn giải phóng các yếu tố sinh học quan trọng, bao gồm yếu tố tăng trưởng chuyển đổi beta (TGF-β), IGF-1 và canxi. 200.212.213 Những chất này ảnh hưởng sâu sắc đến sự phát triển, tăng sinh và xu hướng di căn của tế bào ung thư, do đó tạo ra một môi trường thuận lợi cho sự hình thành và tiến triển của các tổn thương xương.
Di căn não
Di căn não, một trường hợp phổ biến đáng tiếc ở những bệnh nhân được chẩn đoán mắc ung thư phổi, vú và ung thư hắc tố, có liên quan đến tiên lượng không thuận lợi và giảm tỷ lệ sống sót. 214 Sự luân hồi của các tế bào khối u qua hàng rào máu não (BBB) thông qua các cơ chế đa dạng thể hiện một bước quan trọng trong sự khởi đầu của di căn não. Nó là một yếu tố quyết định trong tính cơ quan quan sát thấy trong sự lan tỏa ung thư. 215 Tính toàn vẹn của BBB bị tổn hại, thường liên quan đến sự điều chỉnh tăng của các gen cụ thể, đóng một vai trò quan trọng trong quá trình này. 216.217 Ví dụ, hoạt động phân giải protein của cathepsin S, được trung gian bởi sự tương tác của nó với phân tử kết dính JAM-B, có thể gây ra rò rỉ BBB. Ức chế biểu hiện của cathepsin S làm giảm rõ rệt khả năng di căn não. 218 Di căn não từ ung thư vú ba âm tính hoặc loại cơ bản thường phá vỡ BBB, trái ngược với ung thư vú HER2 / neu dương tính, có xu hướng duy trì tính toàn vẹn của BBB. Hiện tượng này có liên quan chặt chẽ đến biểu hiện khác biệt của chất vận chuyển glucose 1 (GLUT1) và protein kháng ung thư vú (BCRP). 219 Hơn nữa, sự biểu hiện tăng cao của các phân tử kết dính, bao gồm MUC1, VCAM1 và VLA-4, trong các tế bào ung thư vú đã được xác định là một yếu tố góp phần tạo điều kiện thuận lợi cho di căn não, do đó tăng cường sự bám dính của tế bào khối u. 220 Đáng chú ý, các tế bào khối u nguyên phát cũng có thể tạo điều kiện thuận lợi cho di căn não bằng cách trao đổi exosome, là những vỏ bọc mang miRNA giao tiếp với các hốc trước di căn. 221 Một khi các tế bào ung thư xâm nhập thành công trong não, BBB có thể chuyển đổi vai trò của nó, chuyển từ một hàng rào bảo vệ thành một trở ngại chống lại các can thiệp điều trị, do đó làm phức tạp hiệu quả điều trị. 21
Cơ chế trao đổi chất của tế bào khối u rất quan trọng đối với sự xâm lấn và di căn của ung thư. Các loại khối u khác nhau có thể dẫn đến sự thay đổi đáng kể trong các đặc điểm trao đổi chất của di căn não. 222.223 Một số khối u thể hiện xu hướng glycolyis kỵ khí, trong khi những khối u khác dựa vào quá trình phosphoryl hóa oxy hóa (OXPHOS) để sản xuất năng lượng. 224 Với các cơ chế lưu trữ và tiêu thụ năng lượng đặc biệt của não, các tế bào khối u buộc phải thích nghi với vi môi trường trao đổi chất của chúng. 225 Phân tích bộ gen về di căn não trong khối u ác tính đã tiết lộ rằng các tế bào khối u có thể biểu hiện các gen liên quan đến con đường OXPHOS ở mức độ cao. 226 Ngoài ra, ức chế hoạt động của OXPHOS đã được chứng minh là ngăn ngừa di căn não của khối u ác tính ở mô hình chuột. 226 Hơn nữa, sự biểu hiện tăng cao của protein liên kết axit béo 7 (FABP7) trong ung thư vú có liên quan chặt chẽ với tỷ lệ di căn não cao. FABP7 tạo điều kiện cho kiểu hình glycolytic và lưu trữ các giọt lipid, do đó cho phép các tế bào ung thư vú dương tính với HER2 thích nghi hiệu quả hơn với môi trường vi mô tương đối thiếu oxy và hạn chế chất dinh dưỡng của não. 227
Tế bào thần kinh và tế bào thần kinh đệm hoạt động cùng nhau để xây dựng PMN của não và tương tác của chúng với tế bào ung thư rất quan trọng để thúc đẩy di căn não. 228 Axit gamma-aminobutyric (GABA) là một chất dẫn truyền thần kinh ức chế đóng một vai trò quan trọng trong hệ thần kinh trung ương. 229 Trong phân tích lâm sàng về di căn não HER2+ và TNBC, các tế bào ung thư đã được quan sát thấy biểu hiện quá mức các protein liên quan đến GABA (chẳng hạn như thụ thể GABAA, chất vận chuyển GABA, transaminase GABA và glutamate decarboxylase). Biểu hiện quá mức này ảnh hưởng đến tính hướng cơ quan của di căn khối u. 230 Tế bào thần kinh glutamatergic có thể hình thành các khớp thần kinh giả ba bên với các tế bào ung thư vú, một cấu trúc giữa các tế bào đặc biệt hướng tín hiệu glutamate từ tế bào thần kinh đến tế bào ung thư. 231 Tương tác giữa các tế bào này hỗ trợ sự tồn tại và tăng sinh của các tế bào ung thư vú trong não, do đó giải thích sự ưa thích cụ thể của các tế bào này đối với cơ quan này. Hơn nữa, các tế bào khối u di căn não có thể cung cấp cGAMP thông tin thứ hai (GMP-AMP tuần hoàn) đến tế bào hình sao thông qua các mối nối khe hở, do đó kích hoạt các con đường tín hiệu STAT1 (đầu dò tín hiệu và chất kích hoạt phiên mã 1) và yếu tố hạt nhân kappa B (NF-κB) trong các tế bào khối u thông qua một loạt các tầng. 232 Hai con đường tín hiệu này có liên quan mật thiết đến sự tăng trưởng, tăng sinh và sự sống sót của các tế bào khối u. 225.233
Di căn gan
Gan là một cơ quan có mạch máu cao, đóng vai trò là mục tiêu di căn xa cho vô số khối u rắn, bao gồm cả các khối u có nguồn gốc từ vú, tuyến tụy và đại trực tràng. 234.235 Các tế bào khối u được lan tỏa đến các hốc tiềm năng qua máu, và gan nhận máu từ cả động mạch gan (~ 25%) và tĩnh mạch cửa (~ 75%), cung cấp một con đường trực tiếp cho các tế bào khối u đến gan. 45.236 Ngược lại, tốc độ dòng chảy thấp trong các hình sin gan cho phép giữ lại và lắng đọng các tế bào khối u trong gan, kéo dài thời gian lưu giữ chúng. Ngược lại, tính thấm cao của các tế bào nội mô hình sin gan và màng đáy không hoàn chỉnh tạo điều kiện cho tế bào khối u xâm nhập vào thành mạch và sau đó xâm nhập vào nhu mô gan. 225.237 Các tế bào CRC có nhiều khả năng bị “bắt giữ” trong gan trong quá trình di căn hơn là ở lại trong máu ngoại vi. Xu hướng di căn gan tăng lên này là đặc trưng của CRC. 235.238 Hơn nữa, gan thể hiện khả năng dung nạp miễn dịch đặc biệt, đặc biệt là đối với các tế bào NK, có thể cản trở khả năng tiêu diệt các tế bào khối u của hệ thống miễn dịch. 239.240
Exosome đóng một vai trò quan trọng trong giao tiếp giữa các tế bào và là công cụ trong quá trình hình thành PMN trong gan. 235 Trong di căn gan ung thư tuyến tụy, các exosome chứa yếu tố ức chế di chuyển đại thực bào (MIF) có thể kích hoạt đặc hiệu các tế bào Kupffer trong gan dưới sự trung gian của αvβ5 integrin, do đó gây ra sự bài tiết TGF-β và thúc đẩy di căn gan đặc hiệu của khối u. 182 Ngoài ra, tế bào gan có thể đáp ứng với các cytokine do các khối u tiết ra, chẳng hạn như IL-6, bằng cách sản xuất các chất thu hút hóa học tế bào tủy, chẳng hạn như amyloid A (SAA) huyết thanh. Chúng tham gia vào việc hình thành một vi môi trường viêm và xơ hóa tạo điều kiện cho sự phát triển và lan tỏa của các tế bào khối u di căn trong gan. 234 Ngoài ra, exosome có thể mang CD39 và CD73, ức chế chức năng tế bào T và hỗ trợ khối u thoát khỏi sự giám sát miễn dịch. 241 Neutrophils có thể giải phóng NET, có chứa các thành phần DNA thúc đẩy sự tăng sinh và di chuyển của các tế bào khối u bằng cách kích hoạt CCDC25 (một protein điều hòa chu kỳ tế bào), do đó tạo điều kiện thuận lợi cho di căn gan. 242
Các tế bào khối u thích nghi với những thay đổi trong môi trường vi mô di căn của gan thông qua các đột biến gen cụ thể hoặc biểu hiện bất thường. DAMTS10, NELL1 và RXFP3 được coi là các gen đặc hiệu di căn gan, thể hiện các đột biến chỉ có ở các vùng di căn gan nhưng không có ở CRC không có di căn gan. 243 Tế bào CRC di căn gan điều chỉnh tăng yếu tố phiên mã GATA6, làm tăng biểu hiện của aldolase B (ALDOB). Điều này mang lại khả năng chuyển hóa fructose và tăng cường khả năng tăng sinh của các tế bào khối u sau khi di căn. 244 Trong bối cảnh di căn gan, biểu hiện SERPINE2 tăng đã được quan sát thấy để tăng cường tín hiệu thụ thể yếu tố tăng trưởng biểu bì (EGFR), có lợi cho sự tăng sinh của các tế bào khối u. 245 Biểu hiện của SERPINE2 bị ảnh hưởng bởi tình trạng methyl hóa DNA, do đó chỉ ra rằng những thay đổi biểu sinh cũng có thể ảnh hưởng đến quá trình di căn gan. 246
Di căn phổi
Phổi có tỷ lệ di căn cao nhất, đặc biệt là ở bệnh nhân ung thư vú, ung thư hắc tố và ung thư tuyến giáp. 225.247 Mạng lưới mạch máu rộng lớn của phổi cung cấp một môi trường thuận lợi cho các tế bào khối u bám dính, giãn mạch và thiết lập vi di căn. Ví dụ, các tế bào ung thư tuyến giáp thường di căn qua máu, và vì phổi là điểm cuối của hệ thống tĩnh mạch chủ trên, điều này tạo điều kiện thuận lợi cho sự di căn của chúng đến phổi. 45.248 Mức oxy cao điển hình trong phổi hoàn toàn trái ngược với môi trường thiếu oxy của xương và gan. Các tế bào khối u di căn đến phổi phải điều chỉnh các con đường trao đổi chất của chúng để phù hợp với môi trường vi mô và giảm thiểu tổn thương oxy hóa. 249 Kiểm tra các phiên mã đơn bào của vi di căn ung thư vú trong phổi cho thấy mức độ hoạt động OXPHOS tăng cao, trái ngược với các phương pháp sản xuất năng lượng được quan sát thấy trong các tế bào ung thư vú nguyên phát. 250 Kích hoạt con đường tín hiệu Notch thúc đẩy sự biểu hiện của các gen liên quan đến EMT, cho phép các tế bào ung thư vú có được khả năng di cư và xâm lấn tạo điều kiện cho di căn. 251 Ví dụ, khi các tế bào ung thư vú xâm lấn vào phổi, chúng tạo ra tenascin C, giúp tăng cường tín hiệu Notch. 252 Protein tiết ra có tính axit và giàu cysteine (SPARC) có nguồn gốc từ khối u ác tính thúc đẩy di căn phổi bằng cách tăng tính thấm của mạch máu và thúc đẩy sự kết dính của các tế bào khối u với các tế bào nội mô mạch máu, chủ yếu thông qua các cơ chế phụ thuộc VCAM-1. 253
Cả tế bào ung thư vú và ung thư hắc tố đều biểu hiện nồng độ thụ thể CXCR4 và CCR7 cao, cho phép chúng di chuyển đến phổi để đáp ứng với phối tử CXCL12 và CCL21. 254 Exosome được giải phóng từ CSC CD103 + được làm giàu cho miR-15b-3p, thúc đẩy sự xâm nhập và phát triển của các tế bào ung thư biểu mô tế bào thận tế bào trong (CCRCC) trong phổi và đẩy nhanh quá trình di căn. 255 EV được giải phóng bởi các tế bào ung thư biểu mô tế bào gan (HCC) có chứa nidogen 1, giúp tăng cường hình thành mạch và kích hoạt nguyên bào sợi trong phổi, do đó góp phần vào sự sống sót và tăng sinh của các tế bào khối u. 256
U xương, một bệnh ác tính nguyên phát có tính đại diện cao trong sarcoma xương và mô mềm, chủ yếu lan tỏa qua hệ thống mạch máu mà không liên quan đến hệ thống bạch huyết, với phổi thường đóng vai trò là điểm di căn chính của nó. 257 Vi môi trường đóng một vai trò quan trọng trong việc điều chỉnh hành vi của các tế bào u xương, ảnh hưởng không chỉ đến các đặc tính tăng sinh, tĩnh lặng, xâm lấn, di cư và kháng thuốc của chúng mà còn góp phần vào sự phát triển của tính không đồng nhất của khối u nội tại. 257 Bằng cách giải phóng EV, các tế bào u xương có thể điều khiển môi trường phổi từ xa, do đó tạo ra một hốc tiền di căn cho các tế bào khối u di chuyển. 258
Hơn nữa, tế bào gốc trung mô (MSC) thể hiện mối liên hệ sâu sắc với cả tiến triển di căn và kháng điều trị của u xương. 259 Cụ thể, các EV do tế bào u xương, có chứa TGF-β, có khả năng kích thích MSC giải phóng IL-6, từ đó kích hoạt các con đường tiến triển khối u qua trung gian STAT3. Kích hoạt này thúc đẩy sự hình thành các ổ di căn trong phổi và thúc đẩy sự trưởng thành của các MSC này.260 Hơn nữa, EV có nguồn gốc từ cả tế bào u xương và hốc di căn có khả năng đáng chú ý trong việc lập trình lại nguyên bào sợi cơ và tế bào gốc u xương thành kiểu hình xơ hóa, một quá trình then chốt cho sự xâm nhập di căn. 261.262 Trong dòng di căn xương xương, protein liên kết tế bào xương Ezrin cung cấp giàn giáo thiết yếu, do đó tăng cường sự sống sót của các tế bào khối u lan tỏa trong điều kiện căng thẳng ban đầu trong phổi. 263 Hơn nữa, hệ thống RANK-RANKL-OPG đã được xác định là những yếu tố quan trọng ảnh hưởng đến sự hình thành hốc trước di căn trong phổi. 264
Di căn khác
Hiểu biết sâu sắc hơn về di căn tế bào khối u trong hệ thống bạch huyết và phúc mạc có thể tạo điều kiện phát triển các chiến lược điều trị hiệu quả hơn và nâng cao hiểu biết của chúng ta về giai đoạn ung thư. 191 Cấu trúc của mạch bạch huyết cho phép các tế bào lớn hơn đi qua và tốc độ dòng chảy chậm của bạch huyết tạo cơ hội cho các tế bào ung thư bám vào thành mạch bạch huyết. 265 Các hạch bạch huyết không chỉ đóng vai trò là điểm đến ban đầu cho các tế bào khối u sau khi chúng rời khỏi khối u nguyên phát266 mà còn là các hốc trước khối u, cung cấp một môi trường được bảo vệ và hỗ trợ cho sự tăng sinh của các tế bào khối u lan tỏa. Hơn nữa, các hạch bạch huyết thường nằm ở các khu vực quan trọng của cơ thể, chẳng hạn như cổ, nách và háng, gần nhiều cơ quan quan trọng. Cấu hình này tạo điều kiện thuận lợi cho sự lan tỏa của các tế bào ung thư thông qua hệ thống bạch huyết. Các hạch bạch huyết đóng vai trò là lính canh của hệ thống miễn dịch và thể hiện hàm lượng chất dinh dưỡng và yếu tố tăng trưởng phong phú. Tuy nhiên, các tế bào ung thư sử dụng các cơ chế trốn tránh miễn dịch, chẳng hạn như điều hòa tăng biểu hiện MHC-I và PD-L1, để trốn tránh sự giám sát miễn dịch và tăng sinh trong các hạch bạch huyết. 269
Di căn phúc mạc là một trường hợp phổ biến trong ung thư buồng trứng, theo đó các tế bào ung thư đã tách ra khỏi bề mặt khối u nguyên phát được dịch phúc mạc mang theo và bám dính với số lượng lớn vào bề mặt phúc mạc. Sự hiện diện của một số lượng đáng kể tế bào mỡ trong phúc mạc có liên quan đến việc thúc đẩy sự phát triển của tế bào khối u thông qua việc giải phóng lipid, cytokine (chẳng hạn như IL-8) và điều chỉnh tăng biểu hiện protein 4 liên kết axit béo. 271
Nhắm mục tiêu di căn ung thư
Trong ung thư, ngăn ngừa hoặc đảo ngược di căn khối u là một trong những mục tiêu lâm sàng thách thức và cấp bách nhất. Để giải quyết thách thức này, các nhà khoa học và bác sĩ lâm sàng đã điều tra cơ chế phân tử của di căn khối u từ nhiều góc độ bằng cách nhắm mục tiêu trực tiếp vào các tế bào ung thư di căn. Điều quan trọng là các tế bào ung thư không hoạt động riêng lẻ mà tham gia vào một “mối quan hệ cộng sinh” phức tạp với vi môi trường xung quanh chúng. Điều này nhấn mạnh sự cần thiết phải nhắm mục tiêu vào môi trường này như một chiến lược điều trị quan trọng. Các chiến lược điều trị di căn khối u đang tiến tới độ chính xác, hiệu quả và khả năng đa mục tiêu cao hơn, cung cấp những con đường đầy hứa hẹn để nâng cao việc chăm sóc ung thư (Hình E). 4) (Bảng 3).
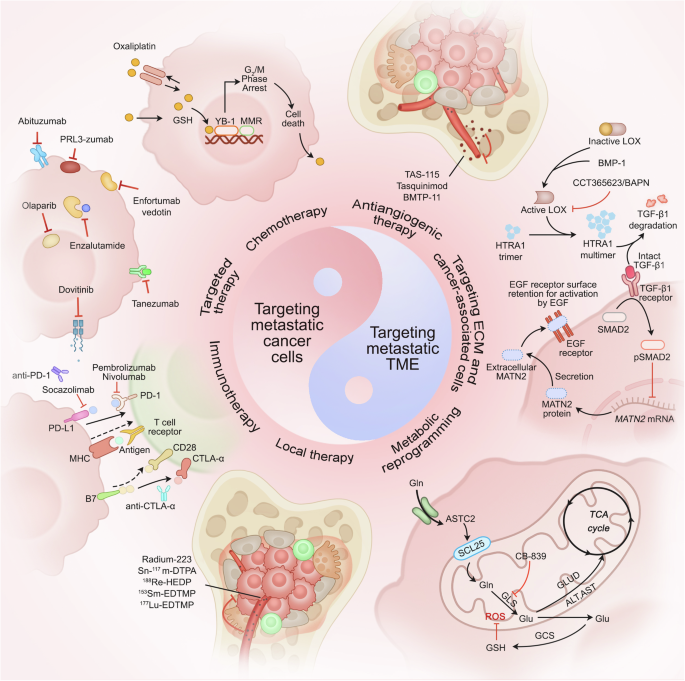
Các chiến lược điều trị nhắm mục tiêu di căn ung thư. Các chiến lược này bao gồm từ tấn công trực tiếp và chính xác các tế bào ung thư di căn đến điều chỉnh TME phức tạp một cách tinh tế, và hơn nữa bao gồm các kế hoạch điều trị cá nhân hóa cho các di căn cơ quan cụ thể. Cụ thể, các chiến lược này tích hợp hóa trị, liệu pháp nhắm mục tiêu, liệu pháp miễn dịch, liệu pháp cục bộ và liệu pháp kết hợp để loại bỏ chính xác tế bào ung thư. Ngoài ra, liệu pháp chống tạo mạch, nhắm mục tiêu vào ECM và các tế bào liên quan đến khối u, đồng thời điều chỉnh cơ chế chuyển hóa khối u gián tiếp tác động đến TME, cuối cùng cung cấp một phương pháp điều trị chính xác hơn cho di căn ung thư
Nhắm mục tiêu vào các tế bào ung thư di căn Hóa
Hóa trị là cách tiếp cận thông thường để điều trị ung thư. Điều này đòi hỏi phải sử dụng các loại thuốc làm gián đoạn sự phát triển và phân chia của tế bào ung thư, cuối cùng dẫn đến việc tiêu diệt hoặc ức chế tăng sinh của chúng. Trong số nhiều bệnh ung thư di căn, ung thư phổi di căn là một trong những khối u rắn đáp ứng tốt nhất với hóa trị. 272 Thuốc dựa trên bạch kim kết hợp với gemcitabine, paclitaxel, docetaxel hoặc vinorelbine đại diện cho các lựa chọn điều trị chính cho bệnh nhân ung thư phổi di căn. Các tác nhân khác, bao gồm docetaxel, erlotinib và pemetrexed, đã nhận được sự chấp thuận lâm sàng là phương pháp điều trị bậc hai. 273 Oxaliplatin thể hiện một phổ hoạt động chống ung thư rộng và đã được chấp thuận để điều trị ung thư đại trực tràng. Nó xâm nhập vào tế bào thông qua cơ chế khuếch tán thụ động và vận chuyển chủ động. Nó trải qua quá trình biến đổi sinh học không enzym với thuốc thử ưa nhân như glutathione (GSH), chuyển đổi nó thành các loài phản ứng hơn. Các dạng phản ứng này của oxaliplatin sau đó tạo thành các phụ gia DNA cộng hóa trị với DNA, ức chế tổng hợp và phiên mã DNA, cuối cùng dẫn đến quá trình chết rụng tế bào. 274
Trong di căn não ung thư, BBB đưa ra một thách thức đáng kể đối với việc khuếch tán các loại thuốc hóa trị liệu vào não. Ngoài việc tiêm trực tiếp vào tuần hoàn não, việc sử dụng các loại thuốc có khả năng đi qua BBB, chẳng hạn như chất alkyl hóa temozolomide, đã nổi lên như một chiến lược ưa thích. 275.276 Đáng chú ý, mức độ biểu hiện của P-glycoprotein trong mạch máu tại các vị trí não di căn thấp hơn so với ở các mạch bình thường và khối u não nguyên phát. Điều này ảnh hưởng đến dòng chảy thuốc và dẫn đến tăng nồng độ dược lý của paclitaxel trong các khối u não di căn. Quan sát này chỉ ra rằng các khối u não di căn có thể dễ bị hóa trị hơn các khối u não nguyên phát. 278
Mặc dù hiệu quả của các tác nhân hóa trị liệu chống lại các tế bào ung thư tăng sinh nhanh chóng, chúng phải đối mặt với nhiều thách thức trong việc ngăn chặn các tế bào ung thư di căn, bao gồm cả sự xuất hiện của kháng thuốc. Trong quá trình kháng hóa trị, CSC có thể tồn tại ở trạng thái ngủ đông trong nhiều thập kỷ sau khi điều trị ban đầu, trốn tránh sự đào thải bằng hóa trị liệu và giữ lại các đặc tính tự đổi mới và biệt hóa của chúng, là những yếu tố quan trọng làm cơ sở cho sự tái phát và kháng thuốc. 279 Các nghiên cứu gần đây đã chỉ ra rằng CSC trở nên giàu sau hóa trị hoặc xạ trị, cho thấy rằng điều trị có thể gây ra tái lập trình hoặc khử biệt hóa các tế bào ung thư bình thường thành những tế bào có đặc điểm CSC tăng cường. 280.281 Trong quá trình hóa trị, CSC trong các bệnh ung thư khác nhau biểu hiện các chất vận chuyển băng cassette liên kết ATP dồi dào, loại bỏ thuốc hóa trị liệu, dẫn đến kháng thuốc. 282.283.284 Ngoài ra, vi môi trường khối u thúc đẩy sự phát triển và tăng sinh của CSC, góp phần di căn và kháng thuốc. 285 Trong tế bào ung thư đại trực tràng, exosome do CAF tiết ra kích hoạt CSC, dẫn đến kháng 5-fluorouracil. 286 Kháng Trastuzumab đã được chứng minh là được trung gian bởi một vòng viêm IL-6 trong CSC ung thư vú HER2+.287
Liệu pháp nhắm mục tiêu
Liệu pháp nhắm mục tiêu có ý nghĩa tối quan trọng trong việc quản lý các tế bào ung thư di căn, vì các tế bào này thường thoát khỏi giới hạn của khối u nguyên phát và lan tỏa qua máu hoặc hệ thống bạch huyết đến các vị trí xa trong cơ thể. Mặc dù hóa trị liệu truyền thống có thể ức chế sự phát triển của tế bào ung thư ở một mức độ nhất định, nhưng chúng thường thiếu tính đặc hiệu và vô tình làm hỏng các tế bào khỏe mạnh. Các liệu pháp nhắm mục tiêu được thiết kế để can thiệp vào các con đường phân tử cụ thể liên quan đến sự phát triển, phân chia, di căn và khả năng tồn tại của tế bào ung thư. Các liệu pháp nhắm mục tiêu có thể nâng cao hiệu quả điều trị đồng thời giảm thiểu tác dụng phụ bằng cách nhận ra và tác động trên các mục tiêu phân tử độc đáo này dành riêng cho tế bào ung thư.
Các tác nhân này thường nhắm mục tiêu vào các thụ thể trên bề mặt tế bào ung thư, con đường tín hiệu hoặc enzym nội bào. Ở bệnh nhân ung thư vú và di căn não, các liệu pháp nhắm mục tiêu HER2, bao gồm trastuzumab, pertuzumab, neratinib, tucatinib và pyrotinib, đã chứng minh hiệu quả trong điều trị ung thư não. 288.289.290.291.292.293 Ở những bệnh nhân ung thư vú dương tính với HER2 đã trải qua điều trị bằng anthracycline hoặc taxanes và đã phát triển di căn não, sự kết hợp của pyrotinib với capecitabine đã được chứng minh là mang lại tỷ lệ sống sót không tiến triển trung bình (PFS) cao hơn là 11,1 tháng so với 4,1 tháng ở nhóm giả dược. 294 Hơn nữa, sự kết hợp của tucatinib với trastuzumab và capecitabine đã chứng minh hiệu quả điều trị tăng cường, với tỷ lệ đáp ứng hệ thần kinh trung ương tăng lên và PFS kéo dài. 295 Ở những bệnh nhân bị ung thư vú dương tính với HER2, dương tính với thụ thể hormone và di căn não, thuốc ức chế CDK4 / 6 abemaciclib cho thấy tỷ lệ lợi ích lâm sàng nội sọ là 24%, cho thấy tiềm năng của nó để nghiên cứu thêm. 296 Ức chế EGFR đại diện cho một chiến lược điều trị đầy hứa hẹn cho ung thư phổi di căn. 297
Các chất ức chế tyrosine kinase đặc hiệu EGFR, bao gồm erlotinib, cetuximab và gefitinib, ức chế EGFR một cách đảo ngược bằng cách ngăn chặn miền liên kết ATP nội bào của nó, do đó điều trị hiệu quả ung thư phổi di căn với đột biến EGFR. 298.299.300 Hơn nữa, các chất ức chế ALK như crizotinib, ceritinib và alectinib đã chứng minh hiệu quả trong điều trị di căn não trong ung thư phổi không tế bào nhỏ (NSCLC). 301 Dasatinib, một chất ức chế Src kinase cản trở sự phát triển của tế bào ung thư, là một chất đối kháng đầy hứa hẹn khác. 302
Ức chế con đường PI3K-Akt-mTOR có thể là một lựa chọn điều trị đầy hứa hẹn cho khoảng 70% bệnh nhân ung thư vú bị di căn xương. 303 Khả năng của các tác nhân này để vượt qua BBB một cách hiệu quả vẫn là một thách thức đáng kể. Tuy nhiên, GDC-0084 và GDC-0068 đã chứng minh khả năng vượt qua rào cản này bằng cách ức chế con đường PI3K-Akt-mTOR và thể hiện tiềm năng điều trị di căn não ung thư vú. 303.304
Ngoài ra, dovitinib, một chất ức chế FGFR đường uống, cho thấy hoạt tính chống khối u vừa phải ở bệnh nhân mCRPC, với độc tính có thể kiểm soát được. Bệnh nhân không trải qua hóa trị liệu có thể được hưởng lợi nhiều hơn từ dovitinib so với docetaxel. 305 Tanezumab, một chất ức chế NGF, thường được sử dụng để điều trị viêm khớp xương và khớp và giảm đau lưng dưới mãn tính. Trong thử nghiệm lâm sàng giai đoạn III đối với cơn đau ung thư di căn xương nặng, tanezumab đã chứng minh sự cải thiện đáng kể về cường độ vị trí đau so với thuốc opioid sau 8 tuần. 306 Enfortumab vedotin, một liên hợp kháng thể-thuốc nhắm mục tiêu vào nectin-4, đã được chứng minh là an toàn và hiệu quả trong điều trị ung thư biểu mô tiết niệu di căn, với tỷ lệ đáp ứng khách quan là 44%. 307
Liệu pháp miễn dịch
Liệu pháp miễn dịch, hướng đến các tế bào ung thư di căn, đại diện cho một tiến bộ mang tính cách mạng trong điều trị ung thư. Điều này đạt được bằng cách tận dụng và tăng cường khả năng của hệ thống miễn dịch của bệnh nhân để xác định chính xác và loại bỏ các tế bào ung thư đã lan sang các vùng khác của cơ thể. Cách tiếp cận này khắc phục những hạn chế của các liệu pháp thông thường và cung cấp một con đường đầy hứa hẹn cho những bệnh nhân ung thư di căn không đáp ứng hoặc đã phát triển khả năng kháng hóa trị liệu truyền thống, xạ trị và các phương pháp điều trị tương tự.
Liệu pháp miễn dịch phát huy tác dụng của nó thông qua vô số cơ chế, với các chất ức chế điểm kiểm soát miễn dịch thu hút sự chú ý đặc biệt. Các tác nhân này loại bỏ các “phanh” ức chế miễn dịch do các tế bào ung thư áp đặt lên hệ thống miễn dịch, chẳng hạn như con đường PD-1 / PD-L1, do đó giải phóng toàn bộ tiềm năng của các tế bào miễn dịch như tế bào T để nhận biết và tấn công tế bào ung thư hiệu quả hơn. 308.309 Đáng chú ý, con đường PD-1 / PD-L1 đóng vai trò là trục điều hòa miễn dịch then chốt, với các loại thuốc như pembrolizumab và nivolumab nhắm mục tiêu PD-1. Những loại thuốc này kiểm soát hiệu quả di căn não ở bệnh nhân ung thư hắc tố và NSCLC và làm giảm các triệu chứng hệ thần kinh trung ương. 310.311 Socazolimab (ZKAB001), một kháng thể đơn dòng đặc hiệu PD-L1, đã được chứng minh là an toàn trong u u xương cấp cao khu trú không tiến triển và có lợi cho các phân nhóm bệnh nhân dương tính với PD-L1 và vi vệ tinh cao. Tuy nhiên, không phải tất cả các kháng thể đơn dòng chống PD-1 (mAb) đều có tác dụng điều trị. Pembrolizumab đã được chứng minh là cải thiện khả năng sống sót không di căn xa ở những bệnh nhân bị u ác tính giai đoạn IIB và IIC sau phẫu thuật cắt bỏ. Tuy nhiên, tác dụng tương tự đã không được quan sát thấy ở những bệnh nhân bị u xương tiến triển. 314 Sau liệu pháp chống tạo mạch cho RCC tế bào trong di căn, bệnh nhân di căn xương được điều trị bằng nivolumab có tiên lượng xấu hơn với PFS thấp hơn và tỷ lệ đáp ứng khách quan. 315 Hơn nữa, ipilimumab, nhắm mục tiêu vào điểm kiểm soát CTLA-4, khi kết hợp với nivolumab trong điều trị di căn não khối u ác tính, tăng cường đáng kể cả tỷ lệ đáp ứng trong hệ thần kinh trung ương và tỷ lệ đáp ứng khách quan trong vùng nội sọ. 316
Các liệu pháp tế bào như liệu pháp tế bào CAR-T cho thấy hứa hẹn đáng kể. Ví dụ, Priceman và cộng sự đã tối ưu hóa miền đồng kích thích 4-1BB trong tế bào HER2-CAR-T. So với đồng kích thích CD28, sửa đổi này cho thấy sự giảm kiểu hình cạn kiệt tế bào T, tăng cường tăng sinh và hoạt động chống khối u mạnh trong các mô hình di căn não ung thư vú. 317
Trị liệu tại chỗ
Ngoài việc nhắm mục tiêu cụ thể các tế bào khối u, các can thiệp điều trị cho các khối u di căn bao gồm phẫu thuật cắt bỏ và các phương thức xâm lấn tối thiểu và không xâm lấn.
Trong bối cảnh bệnh oligodi căn, các thủ thuật phẫu thuật, chẳng hạn như cắt bỏ phổi, 318 cắt gan để di căn gan,319 và mở sọ để di căn não,273 đã chứng minh rằng các kỹ thuật phẫu thuật hiện tại vẫn là lựa chọn khả thi để điều trị bệnh di căn. Tuy nhiên, do sự phức tạp của hành vi di căn và khả năng tham gia của nhiều hệ thống cơ quan, các phương pháp xâm lấn tối thiểu hoặc không xâm lấn đã nổi lên như một lựa chọn chính của các chuyên gia chăm sóc sức khỏe. 320
Xạ trị chùm tia ngoài (EBRT) sử dụng chùm tia bức xạ đi qua các mô bình thường và các cơ quan lân cận để nhắm mục tiêu vào các vị trí bệnh lý cụ thể. Nó bao gồm nhiều kỹ thuật khác nhau, bao gồm cắt bỏ tần số vô tuyến (RFA), xạ trị cơ thể lập thể (SBRT), xạ trị phù hợp ba chiều (3D-CRT) và xạ trị cắt bỏ lập thể hypofractionated (HSRT). Sự ra đời của công nghệ hướng dẫn hình ảnh đã dẫn đến sự gia tăng phổ biến của RFA đối với di căn gan. Phương pháp này đã chứng minh hiệu quả trong việc kiểm soát các khối u có kích thước tổn thương < 3 cm và rìa cắt bỏ > 5 mm, với tỷ lệ kiểm soát cục bộ lâu dài > 90%. 322 Tương tự, trong một nghiên cứu trên hơn 1.000 bệnh nhân di căn phổi được điều trị bằng RFA, tỷ lệ kiểm soát cục bộ trong bốn năm là 89%, với kết quả vượt trội được quan sát thấy ở các khối u nhỏ hơn. 323 Xạ trị cơ thể cắt bỏ lập thể (SABR) là một phương pháp điều trị hiệu quả cho một loạt các tổn thương, bao gồm di căn phổi, gan và xương, bằng chứng là dữ liệu mạnh mẽ từ các cơ sở lâm sàng khác nhau. 324.325 HSRT cải thiện kiểm soát tại chỗ thông qua phác đồ liều cao phân đoạn, dẫn đến tăng tỷ lệ sống sót tổng thể (OS) 5 và 10 năm ở bệnh nhân ung thư vú bị oligodi căn. Số lượng tổn thương có thể ảnh hưởng đến nguy cơ tái phát, đòi hỏi nghiên cứu sâu hơn để xác định những bệnh nhân ung thư vú có khả năng được hưởng lợi từ xạ trị định hướng di căn. 326 Đáng chú ý, xạ trị làm thay đổi hồ sơ cytokine trong máu, do đó làm trung gian giảm đau trong di căn xương thông qua việc điều chỉnh sản xuất cytokine. Một số yếu tố, bao gồm MIP-1δ, MCP-2, TIMP-1, RANTES, IGFBP3 và TNF-α, đã được quan sát thấy có những thay đổi đáng kể cả trước và sau xạ trị. Những thay đổi này có thể đóng một vai trò trong các cơ chế đau cơ bản liên quan đến di căn ung thư. 327
Siêu âm hội tụ có hướng dẫn cộng hưởng từ (MRgFUS, còn được gọi là MRgHIFU) sử dụng chùm siêu âm hội tụ để tạo ra các hiệu ứng nhiệt, cơ học và xâm thực trong các mô mềm, do đó nhanh chóng làm nóng vùng mục tiêu để đạt được sự đông máu và hoại tử mô. 328.329 Nghiên cứu sâu rộng đã được thực hiện trên MRgFUS để điều trị một loạt các tình trạng, bao gồm u xơ tử cung, u xương xương, run cơ bản và ung thư vú, tuyến tiền liệt, gan, tuyến tụy và di căn xương. 330.331 Cơ chế điều trị của MRgHIFU trong di căn xương ung thư chủ yếu là cắt bỏ dây thần kinh màng xương. 332.333 Một nghiên cứu giai đoạn II tiến cứu, nhãn mở, không ngẫu nhiên so sánh MRgHIFU và EBRT đối với di căn xương cho thấy tỷ lệ đáp ứng tổng thể và điểm chất lượng cuộc sống có thể so sánh được sau một tháng, kèm theo tỷ lệ giảm các tác dụng phụ trong nhóm MRgHIFU. 331
Liệu pháp kết hợp
Liệu pháp toàn diện kết hợp những ưu điểm của các phương thức điều trị khác nhau, giải quyết các quá trình tăng sinh và xâm lấn tế bào ung thư một cách toàn diện và hiệp đồng. Cách tiếp cận này không chỉ nhấn mạnh việc loại bỏ trực tiếp các tế bào ung thư mà còn phục hồi và tăng cường chức năng hệ thống miễn dịch của bệnh nhân và điều chỉnh TME, với mục tiêu cuối cùng là đạt được kiểm soát toàn diện ung thư di căn.
Liệu pháp toàn diện thường bao gồm sự kết hợp của liệu pháp nhắm mục tiêu, liệu pháp miễn dịch, hóa trị và xạ trị, trong số các phương thức khác. Một thử nghiệm lâm sàng (RTOG 0320) quan sát thấy nguy cơ nhiễm độc tế bào tăng lên khi xạ trị toàn não (WBRT) được kết hợp với chất ức chế EGFR tyrosine kinase (TKI), cụ thể là erlotinib hoặc temozolomide. Tuy nhiên, các nghiên cứu khác đã chứng minh hiệu quả và an toàn của EGFR-TKI với WBRT trong điều trị di căn não do ung thư phổi tiến triển. 334 So với đơn trị liệu erlotinib, những bệnh nhân được xạ phẫu lập thể (SRS) hoặc WBRT cho thấy tỷ lệ OS tương tự nhưng thời gian tiến triển nội sọ lâu hơn. 273.335 Liệu pháp thiếu androgen (ADT) thường được sử dụng để cải thiện tỷ lệ sống sót của bệnh nhân trong việc điều trị ung thư tuyến tiền liệt di căn. 336 Trong một nghiên cứu so sánh, Kyriakopoulos và cộng sự đã kiểm tra kết quả của hóa trị với liệu pháp nội tiết tố so với ADT ở bệnh nhân ung thư tuyến tiền liệt bệnh lan rộng. Các nhà nghiên cứu định nghĩa bệnh thể tích lớn là sự hiện diện của di căn nội tạng và / hoặc di căn xương ≥4 với ít nhất một ở bên ngoài cột sống và xương chậu. Các phát hiện cho thấy docetaxel kéo dài OS ở những bệnh nhân mắc bệnh thể tích lớn, nhưng không phải ở những người mắc bệnh thể tích thấp. 336 Trong một nghiên cứu trên bệnh nhân ung thư tuyến tiền liệt kháng thiến di căn (mCRPC), Heery và cộng sự đã điều tra hiệu quả của vắc-xin điều trị, PSA-TRICOM, kết hợp với dược phẩm phóng xạ, samarium-153-ethylenediamine tetramethylenephosphonate (Sm-153-EDTMP). Nghiên cứu đã chứng minh rằng liệu pháp kết hợp dẫn đến cải thiện PFS, cũng như xu hướng tăng cường giảm PSA và phản ứng tế bào T đặc hiệu PSA, so với Sm-153-EDTMP đơn thuần. 337
Nhắm mục tiêu vi môi trường khối u di căn
Liệu pháp chống tạo mạch
Liệu pháp chống tạo mạch thể hiện một chiến lược điều trị chính xác nhắm vào các quá trình quan trọng của quá trình hình thành mạch trong quá trình phát triển và di căn của khối u. Hình thành mạch là một yếu tố then chốt trong sự tiến triển của khối u trong TME di căn. Các tế bào ung thư tiết ra vô số yếu tố tạo mạch (chẳng hạn như VEGF và FGF), thúc đẩy sự tăng sinh và di chuyển của các tế bào nội mô mạch máu lân cận. Các tế bào này tạo thành mạng lưới mạch máu mới, do đó cung cấp các chất dinh dưỡng và oxy quan trọng cho các khối u. 338 Bằng cách ức chế hoạt động của các yếu tố tạo mạch trong TME, liệu pháp này cản trở sự hình thành và trưởng thành của các mạch máu mới, do đó tước đi các chất dinh dưỡng thiết yếu và oxy của các tế bào khối u, cuối cùng ức chế sự phát triển, xâm lấn và di căn của chúng. 339
Liệu pháp chống tạo mạch sử dụng các chất ức chế đặc hiệu, chẳng hạn như bevacizumab và anlotinib, để làm gián đoạn hoạt động của các yếu tố tạo mạch hoặc tác động trực tiếp lên các tế bào nội mô mạch máu, phá vỡ sự tăng sinh và di chuyển của chúng và ức chế quá trình hình thành mạch khối u. Các nghiên cứu ban đầu về CRC di căn đã chứng minh được cải thiện hệ điều hành trung bình (20,3 tháng với bevacizumab so với 15,6 tháng không có; P < 0,001) và PFS; 10,6 so với 6,2 tháng; P < 0,001) đối với nhóm bevacizumab so với phác đồ ba truyền thống bao gồm 5-fluorouracil (5-FU), irinotecan và canxi leucovorin (5-FU/LV/Irinotecan). Ngược lại, các thử nghiệm lâm sàng ngẫu nhiên và theo dõi dài hạn đã chứng minh rằng bevacizumab không mang lại lợi ích sống sót ở bệnh nhân ung thư vú di căn và có liên quan đến sự gia tăng đáng kể các tác dụng phụ nghiêm trọng. Do đó, FDA đã rút lại sự chấp thuận đối với chỉ định này, mặc dù Medicare và Dịch vụ Medicaid tiếp tục hỗ trợ việc sử dụng bevacizumab như một phương pháp điều trị đầu tay cho ung thư vú di căn. 340 người
Aflibercept, một thụ thể VEGF được thiết kế, đã được phê duyệt cho các thử nghiệm lâm sàng giai đoạn III của NSCLC di căn và CRC tuyến tụy. 273 TAS-115 nhắm mục tiêu cụ thể vào VEGFR2 và ức chế hoàn toàn cả MET và sự tiến triển của khối u bằng cách ngăn chặn quá trình hình thành mạch. 341 Ramucirumab, một kháng thể IgG1 ở người liên kết với cả HER2 và VEGFR, mang lại lợi ích hạn chế khi kết hợp với docetaxel trong điều trị một số bệnh ác tính hệ tiêu hóa tiến triển. Tuy nhiên, nó cũng cung cấp một con đường đầy hứa hẹn cho các liệu pháp dựa trên kháng thể. 343 Ngoài ra, Taquimmod đặc biệt nhắm mục tiêu vào S100A9, ảnh hưởng đến các tế bào tủy thâm nhiễm khối u theo cách mà chúng trải qua quá trình biến đổi kiểu hình. Sự thay đổi này chuyển đổi chúng từ TAM giống M2 tiền tạo mạch và ức chế miễn dịch thành đại thực bào giống M1 tiền viêm, có tác dụng điều hòa miễn dịch, chống tạo mạch và ức chế di căn. 344 người
Nhắm mục tiêu ECM
ECM, một yếu tố quan trọng của TME, cung cấp hỗ trợ vật lý cho các tế bào khối u và điều chỉnh hành vi sinh học của chúng thông qua một loạt các yếu tố tăng trưởng, enzyme phân giải protein, cytokine và các chất trung gian khác. 345 Trong quá trình di căn khối u, tái tạo và thoái hóa ECM tạo điều kiện thuận lợi cho sự xâm lấn và di chuyển của các tế bào khối u, do đó thúc đẩy sự tiến triển của bệnh. Do đó, các chiến lược điều trị nhắm mục tiêu vào ECM đã được thiết kế để ngăn chặn di căn khối u bằng cách can thiệp vào quá trình phức tạp này.
Protein sốc nhiệt ngoại bào (HSP) đóng một vai trò quan trọng trong việc tái tạo ECM và tăng cường hoạt động MMP, rất quan trọng đối với di căn khối u. 346 AUY922, một chất ức chế HSP90, minh họa cho phương pháp này bằng cách giảm bài tiết fibronectin vào ECM và cản trở sự xâm lấn của ung thư tuyến tiền liệt. 347
Lysyl oxidase (LOX) là một enzyme quan trọng khác tham gia vào quá trình tái tạo ECM. Thuốc ức chế LOX đã là chủ đề của nghiên cứu tiền lâm sàng sâu rộng. 348 Trong số này, β-aminopropionitrile (BAPN) và chất ức chế dựa trên aminomethyl thiophene CCT365623 ngăn chặn hiệu quả sự di chuyển và xâm lấn của tế bào ung thư vú. 349.350 Hơn nữa, PAT-1251 / GB2064, một chất ức chế LOXL2 có tính chọn lọc cao, đã cho thấy hứa hẹn trong việc giảm tích tụ collagen và ức chế sự phát triển của khối u trong môi trường tiền lâm sàng. 351 CCT365623 phá vỡ quá trình đa phân HTRA1, kích hoạt tín hiệu TGF-β1, ức chế biểu hiện MATN2, ức chế lưu giữ bề mặt EGFR và làm suy giảm tín hiệu EGFR. Cuối cùng, tương tự như cắt bỏ gen BAPN hoặc LOX, CCT365623 điều chỉnh giảm MATN2, cản trở sự định vị màng sinh chất EGFR trong các khối u và ức chế sự phát triển và di căn của khối u ở chuột. 352
Integrin, được biểu hiện cao trong các khối u rắn, đóng vai trò là trung tâm tín hiệu truyền thông điệp từ bên trong ra bên ngoài tế bào. Quá trình này điều chỉnh tương tác tế bào-ECM, làm thay đổi độ bám dính, di chuyển và các đặc tính ECM của tế bào. 63 Đáng chú ý, integrin αvβ3 phổ biến hơn trong các khối u di căn so với ung thư tuyến tụy và vú nguyên phát. Điều này tăng cường sự di chuyển và di căn của khối u bằng cách tuyển dụng Src kinase. Biểu hiện chọn lọc của integrin αvβ3 tại các vị trí di căn cung cấp một con đường đầy hứa hẹn để tăng cường việc cung cấp các tác nhân hóa trị liệu cho các tế bào ung thư vú cư trú trong xương với độ chính xác cao hơn. 354 người
Với vai trò phổ biến của ECM trên các loại khối u khác nhau, các liệu pháp nhắm mục tiêu vào ECM có triển vọng ứng dụng rộng rãi. Tuy nhiên, điều cần thiết là phải nhận ra rằng ECM là một hệ thống rất phức tạp và năng động, thành phần và cấu trúc của nó khác nhau đáng kể giữa các loại khối u, giai đoạn và thậm chí cả các cá nhân. Do đó, y học chính xác đòi hỏi phải xem xét cẩn thận những khác biệt này khi phát triển các liệu pháp nhắm mục tiêu ECM.
Nhắm mục tiêu các tế bào liên quan đến ung thư
Nhắm mục tiêu vào các tế bào liên quan đến ung thư trong TME, bao gồm CAF, đại diện cho một cách tiếp cận đầy hứa hẹn để ngăn chặn sự di căn và tiến triển của khối u. Điều này có thể đạt được bằng cách điều chỉnh hoạt động, chức năng và tương tác của các tế bào này với các tế bào khối u.
CCL5, được sản xuất bởi tế bào lympho CD4 và CD8 T trong di căn gan của ung thư đại trực tràng, tạo ra tác dụng gây ra tiền khối u thông qua tín hiệu CCR5. Điều này thúc đẩy tuyển dụng bạch cầu đơn nhân và phân cực M2, tăng cường sự mở rộng CAF và tăng cường việc tiêu diệt các tế bào T CD8 qua trung gian TGF-β bởi Tregs. Đáng chú ý, maraviroc đối kháng CCR5, ức chế CCR5, có liên quan đến quá trình tái phân cực của các đại thực bào liên quan đến khối u, nổi lên như một con đường đầy hứa hẹn để khám phá khoa học và lâm sàng hơn nữa. 355 ·
Với mối tương quan đã được thiết lập giữa nhiễu xuyên âm của các tế bào ung thư di căn và môi trường vi mô của chúng trong quá trình di căn ung thư, ngày càng có sự nhấn mạnh vào việc phát triển các chiến lược điều trị nhắm mục tiêu vào môi trường vi mô này hoặc bản thân nhiễu xuyên âm. Ví dụ, silibinin cản trở sự phát triển của di căn não bằng cách nhắm mục tiêu STAT3 trong tế bào hình sao liên quan đến khối u, do đó làm giảm nhiễu xuyên âm của chúng với các tế bào ung thư và microglia. 356.357
Các chiến lược điều trị nhắm mục tiêu vào CAF mang lại những lợi thế đáng chú ý, vì chúng không chỉ tác động trực tiếp đến các thành phần tế bào quan trọng của TME mà còn gián tiếp ức chế sự phát triển và di căn của khối u bằng cách ảnh hưởng đến toàn bộ vi môi trường. Hơn nữa, với vai trò quan trọng của CAF trong vô số loại khối u, cách tiếp cận này mang lại tiềm năng đáng kể cho các ứng dụng phổ rộng.
Lập trình lại trao đổi chất nhắm mục tiêu
Lập trình lại chuyển hóa của các tế bào khối u được đặc trưng bởi sự hấp thu và sử dụng bất thường các chất dinh dưỡng, chẳng hạn như glucose và glutamine, cũng như tích tụ bất thường và bài tiết các sản phẩm phụ trao đổi chất. Hiện tượng này là dấu hiệu của sự biến đổi ác tính. 358 Việc lập trình lại này đáp ứng nhu cầu năng lượng của sự tăng sinh tế bào khối u nhanh chóng và ảnh hưởng đến khả năng xâm lấn, di chuyển và trốn tránh giám sát miễn dịch của chúng bằng cách thay đổi thành phần chất chuyển hóa trong môi trường vi mô. 359 Do đó, các chiến lược điều trị nhắm mục tiêu tái lập trình trao đổi chất tìm cách cản trở sự di căn và tiến triển của khối u bằng cách điều chỉnh đường phân, glutaminolysis, chuyển hóa một cacbon và chuyển hóa lipid.
Sự tăng sinh và di căn của các tế bào khối u có liên quan chặt chẽ với quá trình glycoly bất thường. 360 Chất ức chế glycolytic 2-deoxy-D-glucose (2-DG) đã được chứng minh là làm giảm sự xâm lấn của các tế bào CRC kháng 5-FU bằng cách điều chỉnh giảm biểu hiện enzyme glycolytic, đồng thời làm suy giảm sự bài tiết các cytokine liên quan đến EMT và bất hoạt các integrin, MMP-10 và MMP-17. 361
Các tế bào khối u sử dụng glutamine làm nguồn nhiên liệu cho chu trình axit tricarboxylic (TCA) và nhắm mục tiêu vào các chất trung gian của chu trình TCA liên quan đến glutaminolysis đã được chứng minh là một phương pháp chống ung thư hiệu quả. 362 Các chất ức chế glutaminase đặc hiệu (GLS) mới, bao gồm các dẫn xuất CB-839 selenadiaazole CPD-20 và CPD-23, đã được quan sát thấy cho thấy sự hấp thu tăng cường trong các tế bào khối u và thể hiện hoạt tính chống ung thư cao hơn đối với các tế bào CRC. CPD-20 và CPD-23 thể hiện sự tích tụ tế bào và khối u được cải thiện, tăng cường ức chế GLS, tăng cảm ứng ROS và hiệu quả tốt hơn trong việc loại bỏ tế bào ung thư. 363 Ngoài ra, khi CB-839 được kết hợp với erlotinib trong liệu pháp kép cho các mảnh ghép NSCLC ở chuột, sự thoái lui khối u nhanh chóng đã được quan sát thấy trong cơ thể. Sự kết hợp này đồng thời cản trở việc sử dụng Gln và Glc của tế bào ung thư, phá vỡ cân bằng nội môi oxy hóa khử và gây ra quá trình tự thực để chống lại ung thư. 364 Tương tự như vậy, CB-839 đã chứng minh hoạt tính chống khối u đáng chú ý trong hai mô hình xenograft của các dòng tế bào TNBC, cả dưới dạng đơn trị liệu và kết hợp với paclitaxel. 365
Các bất thường trong chuyển hóa lipid có liên quan đến một số quá trình tạo khối u, bao gồm tiến triển ung thư và di căn. 366 Luteolin, hoạt động như một chất ức chế tổng hợp axit béo, cản trở quá trình sinh tổng hợp từ mới của các axit béo chuỗi dài và phát huy tác dụng chống ung thư trong CRC bằng cách điều chỉnh vô số con đường tín hiệu khối u, bao gồm IGF-1, Keap1-Nrf2-ARE và Wnt-β-catenin. 367
Chuyển hóa một cacbon là một con đường tạo ra các đơn vị một cacbon cần thiết cho quá trình tổng hợp nucleotide, methyl hóa và sản xuất NADH / NADPH. Các quá trình này duy trì tốc độ tăng sinh cao của các tế bào khối u. 368 Methotrexate và các tác nhân hóa trị liệu nhắm mục tiêu vào các enzym quan trọng liên quan đến chuyển hóa một carbon, chẳng hạn như dihydrofolate reductase và thymidylate synthase, được sử dụng lâm sàng để điều trị một loạt các bệnh ung thư, bao gồm cả CRC. 358
Nhắm mục tiêu di căn đặc hiệu của cơ quan
Nhắm mục tiêu di căn xương
Một phương pháp tiếp cận nhiều mặt là điều cần thiết để kiểm soát hiệu quả di căn xương, bao gồm việc sử dụng kháng thể đơn dòng, TKI, thuốc liên quan đến hormone, bisphosphonate, phân tử nhỏ và thuốc phóng xạ.
Trong bối cảnh điều trị nhắm mục tiêu cho di căn xương, denosumab, một kháng thể đơn dòng, đã chứng minh hiệu quả đặc biệt bằng cách liên kết đặc biệt và ức chế RANKL, do đó cản trở quá trình hấp thu xương qua trung gian tế bào xương. Đây là phương pháp điều trị tiêu chuẩn cho bệnh nhân ung thư di căn xương. 369.370.371.372 Hơn nữa, các thuốc tương tự sinh học của denosumab, chẳng hạn như HS-20090 và QL1206, cung cấp các lựa chọn điều trị mới cho bệnh nhân di căn xương. 373.374 Abituzumab, một chất ức chế integrin pan-αv, đã chứng minh PFS đầy hứa hẹn và tỷ lệ tích lũy thấp của sự tiến triển tổn thương xương ở bệnh nhân không có triệu chứng hoặc bệnh nhân bị ung thư tuyến tiền liệt kháng thiến di căn có triệu chứng nhẹ (mCRPC). Những phát hiện này làm nổi bật hoạt động cụ thể của abituzumab trong các bệnh xương liên quan đến ung thư tuyến tiền liệt và cần được điều tra thêm. 375
Cabozantinib, một TKI đường uống, đã được chứng minh là làm giảm tăng sinh nguyên bào xương và tăng cường hoạt hóa nguyên bào xương. Điều này đạt được bằng cách ức chế sự sắp xếp lại MET và VEGFR-2 xảy ra trong quá trình truyền nguyên bào xương. 376.377 Ngoài ra, nó ảnh hưởng đến các tế bào khối u và TME. 378 Tuy nhiên, hiệu quả lâm sàng của các TKI khác vẫn còn phải được làm rõ. 379.380
ADT là một thành phần cơ bản của việc quản lý ung thư tuyến tiền liệt, đặc biệt là ở giai đoạn di căn và giai đoạn cuối. Enzalutamide, một chất đối kháng thụ thể androgen đường uống, ngăn chặn hiệu quả sự chuyển vị hạt nhân của thụ thể khi liên kết, do đó làm gián đoạn tín hiệu androgen. 381 Nó tăng cường rõ rệt kết quả cho bệnh xương ở cả môi trường khối lượng thấp và lớn382 và thể hiện hiệu quả và an toàn thuận lợi ở bệnh nhân từ 75 tuổi trở lên. Tuy nhiên, cần lưu ý rằng bệnh nhân ung thư tuyến tiền liệt trải qua ADT có thể bị mất xương sớm (trong vòng ba tháng),384 do đó làm tăng nguy cơ gãy xương loãng. 385
Bisphosphonate đại diện cho một loại chất điều chỉnh xương (BMA) thiết yếu khác. Các tác nhân này là chất tương tự của pyrophosphate liên kết với các vị trí liên kết hydroxyapatite trên xương, do đó ức chế quá trình hấp thu xương qua trung gian tế bào hủy xương. Ngoài ra, chúng điều chỉnh chức năng bào hủy xương bằng cách giảm sự phát triển, tuyển dụng và thúc đẩy các tế bào tiền thân của tế bào hủy xương cũng như thúc đẩy quá trình chết rụng của tế bào hủy xương. 386.387 Bisphosphonate đã được phê duyệt để phòng ngừa và điều trị SRE liên quan đến di căn xương khối u rắn. 386 Tuy nhiên, việc sử dụng axit zoledronic trong thời gian dài ở bệnh nhân di căn xương cần được xem xét cẩn thận. 388
Những tiến bộ trong hiểu biết của chúng ta về các cơ chế cơ bản của di căn xương đã dẫn đến việc xác định một số phân tử quan trọng có thể đại diện cho các mục tiêu điều trị đầy hứa hẹn. Sự biểu hiện tăng cao của phosphatase của gan-3 tái tạo (PRL-3) trong các mô khối u đã được chứng minh là góp phần vào di căn. Một thử nghiệm lâm sàng giai đoạn 1 đã chứng minh tính an toàn và khả năng dung nạp của PRL3-zumab trong các khối u tiến triển, do đó khuyến khích sự tiến bộ hơn nữa của các liệu pháp nhắm mục tiêu PRL-3. 389 Ức chế các đồng dạng poly (ADP-ribose) polymerase (PARP) (PARP-1, -2, -3) đã được chứng minh là làm giảm sự phát triển của khối u trong ống nghiệm và in vivo trong các mô hình ung thư ở người. Trong các thử nghiệm giai đoạn III, olaparib, một chất ức chế PARP, cho thấy PFS chụp X quang kéo dài đáng kể ở bệnh nhân mCRPC so với enzalutamide hoặc abiraterone. 390 Các thụ thể mạch máu khối u đại diện cho các mục tiêu hấp dẫn để khám phá và phát triển thuốc theo hướng phối tử. BMTP-11, được phát triển bởi Pasqualini và cộng sự, nhắm mục tiêu vào các khối u tủy xương bằng cách liên kết với mô típ liên kết phối tử của thụ thể interleukin-11 α (IL-11Rα) trong hệ mạch khối u của con người, do đó gây ra quá trình chết rụng. 391
Đồng vị phóng xạ giải phóng các tia α, β, γ và các tia khác, gây ra quá trình ion hóa, tạo ra các gốc tự do, đứt chuỗi DNA và cuối cùng là quá trình chết rụng tế bào ung thư. Các thử nghiệm lâm sàng về di căn xương đã sử dụng radium-223, Sn-117, rhenium-188, lutetium-177 và samarium-153 để chứng minh tác dụng chống khối u và giảm đau. Radium-223 chủ yếu được sử dụng trong các thử nghiệm lâm sàng để điều trị di căn xương và có tác dụng chống khối u và giảm đau. 392.393 Trong thực hành lâm sàng, radium-223 làm giảm thời gian nằm viện, cải thiện tỷ lệ sống sót mà không có các biến cố xương có triệu chứng (SSE) và nâng cao chất lượng cuộc sống liên quan đến sức khỏe (QOL) ở bệnh nhân mắc mCRPC. 394 Phân tích về EuroQoL 5D và Đánh giá chức năng của liệu pháp ung thư-Các dụng cụ tuyến tiền liệt cho thấy rằng lợi ích sống sót liên quan đến việc sử dụng radium-223 dẫn đến những cải thiện đáng kể về QOL. Những lợi ích này bao gồm tỷ lệ tăng bệnh nhân ung thư tuyến tiền liệt kháng thiến trải qua QOL tăng cường và tốc độ giảm QOL chậm hơn. 395 Sn-117 meta-diethylenetriaminepentaacetic acid (DTPA) (Sn-117m-DTPA) là một đồng vị phóng xạ của thiếc được phát triển như một loại thuốc phóng xạ. 396 So với radium-223, Sn-117m-DTPA dường như có độc tính tủy xương thấp hơn. Một thử nghiệm lâm sàng giai đoạn II đang được tiến hành để xác nhận hiệu quả của Sn-117m-DTPA trong việc giảm đau và hoạt động chống khối u ở bệnh nhân mCRPC. 397 Rhenium-188 được lấy từ máy phát 188W/188Re và liên quan đến ít vấn đề về bảo vệ bức xạ hơn so với 131mà tôi đã làm. 188Re-HEDP an toàn và dung nạp tốt, có hiệu quả trong việc giảm đau ở những bệnh nhân bị di căn xương do ung thư phổi và cải thiện chất lượng cuộc sống tổng thể. 398 Samarium-153 là một loại thuốc phóng xạ tìm kiếm xương cao, tương tự như bisphosphonate, liên kết với axit ethylenediamine tetramethylene phosphonic (EDTMP). 399 Ở giai đoạn nặng, cần điều trị giảm nhẹ để di căn xương, tiêm tĩnh mạch 153Sm-EDTMP là một lựa chọn tiềm năng để kiểm soát cơn đau ung thư ở những bệnh nhân không dung nạp hoặc kháng điều trị bằng thuốc. Bệnh nhân được điều trị bằng samarium cần ít hoặc không cần thuốc giảm đau và tiết kiệm chi phí hơn. 400 Trong đau xương do u tủy đa ổ hoặc tổn thương di căn ly giải hỗn hợp, 153Sm-EDTMP và 177Lu-EDTMP cho thấy ái lực cao đối với các tổn thương. Khi được đo bằng Hệ thống đánh giá triệu chứng Edmonton, trạng thái hiệu suất ECOG và thang đánh giá số, 153Sm-EDTMP và 177Lu-EDTMP đã được chứng minh là thuốc phóng xạ an toàn và hiệu quả để giảm đau ung thư do tổn thương di căn có u tủy hoặc đặc điểm ly giải hỗn hợp. 401 ·
EBRT tăng tiên lượng và giảm SRE ở bệnh nhân di căn xương không có triệu chứng. Thử nghiệm giai đoạn II do Gillespie và cộng sự thực hiện đã chứng minh hiệu quả của EBRT trong việc giảm nguy cơ SRE và nhập viện, đồng thời cải thiện hệ điều hành ở những bệnh nhân có nguy cơ cao, di căn xương không có triệu chứng. 321 EBRT được công nhận là phương pháp điều trị tiêu chuẩn để giảm đau liên quan đến di căn xương có triệu chứng, cung cấp một phương pháp tiếp cận hiệu quả và được áp dụng phổ biến. Khi xây dựng kế hoạch điều trị, điều cần thiết là phải xem xét hoàn cảnh và đặc điểm riêng của mỗi bệnh nhân. Nghiên cứu và thử nghiệm sâu hơn phải xác nhận kết quả điều trị và cung cấp thêm hướng dẫn cho thực hành lâm sàng.
Nhắm mục tiêu di căn não
Xạ trị toàn não (WBRT), can thiệp phẫu thuật và xạ phẫu lập thể là những lựa chọn ưu tiên để điều trị di căn não tại chỗ. 402 Một đánh giá về các nghiên cứu trước đây đã chỉ ra rằng can thiệp phẫu thuật có thể trì hoãn hiệu quả sự tái phát ở một số bệnh nhân di căn não và do đó cải thiện tỷ lệ sống sót trung bình của họ. 403.404 Sự kết hợp giữa phẫu thuật và WBRT đã được chứng minh là kéo dài đáng kể thời gian tái phát và cải thiện đáng kể tỷ lệ sống sót trung bình, do đó dựa trên lợi ích của WBRT đơn thuần. 405.406
Ngoài các liệu pháp khu trú, các phương pháp điều trị toàn thân như hóa trị và liệu pháp nhắm mục tiêu cũng rất quan trọng trong việc kiểm soát di căn não. Tuy nhiên, hóa trị liệu gây độc tế bào truyền thống đã thể hiện hiệu quả hạn chế trong điều trị di căn não do BBB. 407 Các liệu pháp nhắm mục tiêu được thiết kế để nhắm mục tiêu vào các đột biến cụ thể trong ung thư phổi, ung thư vú và khối u ác tính đã nổi lên như những công cụ quan trọng trong điều trị di căn não.
TKI, chẳng hạn như erlotinib, gefitinib và osimertinib, nhắm mục tiêu vào đột biến EGFR trong di căn não NSCLC, đã chứng minh tỷ lệ đáp ứng vượt quá 50%, kéo dài thời gian sống trung bình một cách hiệu quả. 408.409.410 Trong các trường hợp di căn não liên quan đến sắp xếp lại ALK trong NSCLC, alectinib, ceritinib và brigatinib, cho thấy sự xâm nhập hiệu quả của BBB, cho thấy hứa hẹn và cần được nghiên cứu thêm. 411.412.413
Trong số những bệnh nhân ung thư vú và di căn não, những người có tình trạng HER2 dương tính có nhiều khả năng có tỷ lệ liên quan đến não cao hơn. Các liệu pháp nhắm mục tiêu phù hợp với các phân nhóm phân tử của ung thư vú nguyên phát đã được phát triển. Trong di căn não dương tính với HER2, một loạt các thuốc chống HER2 đã là đối tượng của nghiên cứu lâm sàng, bao gồm kháng thể đơn dòng (ví dụ: trastuzumab và pertuzumab), liên hợp kháng thể-thuốc (ví dụ: T-DM1) và TKI phân tử nhỏ (ví dụ: lapatinib, neratinib, tucatinib và pyrotinib). 414 Thử nghiệm tiền lâm sàng đã chứng minh hoạt tính hạn chế của lapatinib như một tác nhân duy nhất nhưng cho thấy hiệu suất tốt khi kết hợp với capecitabine, đạt tỷ lệ đáp ứng trên 65% ở bệnh nhân chưa xạ trị và 20% ở bệnh nhân kháng phóng xạ. 415.416.417 Trong một nghiên cứu giai đoạn 3 liên quan đến 991 bệnh nhân đã trải qua điều trị di căn não dương tính với HER2, trastuzumab đã chứng minh hiệu quả và kết quả an toàn vượt trội so với capecitabine kết hợp với lapatinib. 288 Sự kết hợp của các chất ức chế nhắm mục tiêu HER2 với hóa trị liệu gây độc tế bào đã chứng minh một số hiệu quả trong các thử nghiệm lâm sàng; tuy nhiên, những lo ngại đã được nêu ra liên quan đến sự không ổn định của phản ứng và tần suất của các tác dụng phụ. Do đó, phải nỗ lực hơn nữa để tối ưu hóa hiệu quả và giảm độc tính. 418
Ở những bệnh nhân bị ung thư hắc tố và di căn não, đột biến trong BRAF và NRAS cho thấy tiềm năng của các phương pháp điều trị nhắm mục tiêu. 419 Các nghiên cứu lâm sàng ban đầu đã chứng minh hiệu quả và khả năng dung nạp của dabrafenib và trametinib ở bệnh nhân di căn não đột biến BRAF, với khoảng một phần ba số bệnh nhân bị khối u ác tính không thể cắt bỏ hoặc di căn có lợi ích lâu dài. 420.421 Hơn nữa, thuốc ức chế MEK đã được kết hợp với thuốc ức chế BRAF, bao gồm encorafenib kết hợp với binimetinib và vemurafenib kết hợp với cobimetinib, và đã chứng minh các đáp ứng lâm sàng hiệu quả. 422.423
Targeting liver metastasis
Despite advancements in chemotherapy that have led to improved survival rates, only 10–20% of patients with liver metastasis are eligible for resection. Radical surgery remains the standard treatment for this patient population.424 The feasibility of liver resection is clinically assessed based on patient tolerance, extent of the tumor, and residual liver function, often with systemic chemotherapy. This enables some patients to develop resectable tumors following the initial drug therapy.425,426 Surgical resection has been demonstrated to confer substantial survival benefits, with 5-year OS rates ranging from 20 to 50%.427,428 Conversely, the role of radiotherapy in the management of liver tumors is limited by concerns regarding local control and toxicity.429 SBRT is a precise and effective means of delivering high-dose radiation to liver metastasis. This approach effectively induces DNA damage and fragmentation, resulting in excellent local control with minimal side effects.429
It is estimated that over 50% of patients diagnosed with CRC will eventually develop metastasis, with the liver being the most common site of recurrence.430 In addition to downstaging tumors and converting unresectable to resectable cases,431 the use of 5-FU and leucovorin significantly enhances the median survival of patients with liver metastasis.432 The combination of irinotecan, fluorouracil, and leucovorin significantly prolongs PFS, improve response rates and extend OS.433 Moreover, the incorporation of oxaliplatin into fluoropyrimidine regimens markedly enhanced pathological complete response rates and reduced perioperative metastasis.434
Thuốc chống tạo mạch thường được sử dụng trong liệu pháp nhắm mục tiêu di căn gan, thường kết hợp với hóa trị, để tăng cường hiệu quả. Việc kết hợp bevacizumab vào hóa trị liệu đầu tay cho CRC di căn làm tăng đáng kể PFS trung bình từ 8,0 lên 9,4 tháng. 435 Hơn nữa, cetuximab, khi kết hợp với các thuốc khác, được dung nạp tốt, giảm nguy cơ tiến triển bệnh và tăng đáng kể tỷ lệ đáp ứng tổng thể (61% so với 37%) so với fluorouracil/leucovorin kết hợp với oxaliplatin. 436
Ngoài các liệu pháp chống tạo mạch, liệu pháp miễn dịch đã nổi lên như một lựa chọn điều trị đầy hứa hẹn. Ở những bệnh nhân bị CRC và di căn gan, đáp ứng với việc phong tỏa điểm kiểm soát miễn dịch phụ thuộc vào tình trạng bất ổn định vi vệ tinh DNA (MSI) hoặc sửa chữa không phù hợp. 437.438 Ở những bệnh nhân có MSI (MSI-H) cao hoặc thiếu sửa chữa không khớp, nivolumab, một chất ức chế PD-1, đạt được tỷ lệ đáp ứng khách quan là 31,1%. Điều này thể hiện các phản ứng bền vững và kiểm soát bệnh tật và có thể đại diện cho một mô hình điều trị mới cho những bệnh nhân này. 439 Chất ức chế PD-L1 atezolizumab, khi được sử dụng kết hợp với fluorouracil, leucovorin, oxaliplatin, irinotecan và bevacizumab, đã được chứng minh là an toàn và hiệu quả trong việc cải thiện PFS. 440
Nhắm mục tiêu di căn phổi
Việc điều trị di căn phổi đòi hỏi một phương pháp tiếp cận nhiều mặt bao gồm các phương thức điều trị phẫu thuật, hóa học, radiotherapeutic, trị liệu miễn dịch và nhắm mục tiêu, được điều chỉnh cho phù hợp với giai đoạn và đặc điểm của khối u. 189 Cụ thể, các thủ thuật phẫu thuật và xạ trị chủ yếu được sử dụng để điều trị các tổn thương di căn hạn chế, trong khi hóa trị, liệu pháp miễn dịch và liệu pháp nhắm mục tiêu hiệu quả hơn trong việc giải quyết di căn toàn thân lan rộng. Tuy nhiên, hóa trị liệu có liên quan đến các tác dụng phụ đáng kể và một số thuốc, bao gồm paclitaxel441 và gemcitabine,442 có thể vô tình góp phần vào sự phát triển di căn phổi, đòi hỏi các bác sĩ lâm sàng phải thận trọng. Do đó, liệu pháp nhắm mục tiêu và liệu pháp miễn dịch, mang lại độ chính xác đáng kể và giảm độc tính, đã nổi lên như những con đường nghiên cứu đầy hứa hẹn để kiểm soát di căn phổi.
Biểu hiện gen bất thường là động lực chính của sự tiến triển của khối u, kháng điều trị và di căn phổi. 443 Đáng chú ý, những gen rối loạn điều hòa này cũng đại diện cho các mục tiêu điều trị mới. Di căn phổi là một hiện tượng phổ biến trong TNBC và gen đáp ứng với protein bổ sung 32 (RGCC) đã được xác định là động lực chính của di căn phổi TNBC. Điều này đạt được thông qua việc tăng cường hoạt động kinase PLK1, thúc đẩy quá trình phosphoryl hóa AMPKα2 và tín hiệu xuôi dòng tiếp theo. Đáng chú ý, sự kết hợp giữa nhắm mục tiêu RGCC với paclitaxel / carboplatin ức chế hiệu quả di căn phổi TNBC ở chuột, cho thấy tiềm năng của RGCC như một mục tiêu cho các chiến lược điều trị. 444 ·
Trong ECM, biểu hiện bất thường của collagen loại X (COL10A1) trong TNBC có thể kích hoạt con đường PI3K/AKT, kích thích hình thành mạch liên quan đến khối u và thúc đẩy sự phát triển TNBC và di căn phổi. 445.446 Do đó, việc giảm điều chỉnh COL10A1 thể hiện một chiến lược điều trị tiềm năng. Tirapazamine, một chất ức chế pan-PI3K, ức chế sự phát triển của di căn phổi trong TNBC bằng cách nhắm mục tiêu vào các phức hợp PI3K / Akt / mTOR 1 và 2 (mTORC1 / 2), làm giảm sự biểu hiện của các protein liên quan đến EMT. 447 Tương tự, isoflavone ononin có nguồn gốc thực vật đã được chứng minh là ức chế sự biểu hiện của các dấu hiệu EMT và metalloproteinase ma trận, do đó đảo ngược quá trình EMT và làm giảm sự phát triển của các khối u TNBC và sự hình thành di căn phổi. 448
Nhắm mục tiêu vào các tế bào khối u nguyên phát có thể gián tiếp giảm thiểu sự tiến triển của di căn phổi. Để ngăn chặn di căn phổi ung thư biểu mô mũi họng (NPC), các chiến lược bao gồm hạ gục giống như chuyển vị hạt nhân thụ thể aryl hydrocarbon 2 (ARNTL2) hoặc nhắm mục tiêu vào trục viêm PLUNC-NLRP3 để thúc đẩy quá trình phổ biến và thoái hóa NLRP3, cũng như ức chế con đường AMOTL2 / LAT / YAP, làm giảm sự di chuyển và xâm lấn của tế bào NPC. 449.450 Trong di căn phổi do sụn sụn, nicotinamide phosphoribosyltransferase thúc đẩy sản xuất lysyl oxidase (LOX) thông qua tín hiệu c-Src và Akt, do đó tăng cường sự di chuyển và xâm lấn tế bào sụn phụ thuộc vào LOX. 451 Trong một nghiên cứu của Wang và cộng sự, sự ức chế con đường c-MYC / Nrf2 đã cản trở sự di chuyển và xâm lấn của các tế bào CRC, do đó ngăn chặn di căn phổi. 452 Trong bối cảnh di căn phổi do u xương xương, vòng phản hồi tín hiệu SDC4-TGF-β và con đường Wnt/β-catenin đại diện cho những con đường đầy hứa hẹn để can thiệp điều trị. 453.454 Hơn nữa, yếu tố tăng trưởng thần kinh (NGF) điều chỉnh tăng matrix metalloproteinase-2 (MMP-2) thông qua con đường MEK / ERK, do đó tăng cường sự di chuyển và xâm lấn tế bào u xương. 455 Larorectinib, một chất ức chế kinase thụ thể tropomyosin, đã được chứng minh là ức chế mạnh tác dụng của NGF đối với di căn phổi, do đó nổi lên như một ứng cử viên điều trị tiềm năng cho di căn phổi do u xương xương. 455
Nhắm mục tiêu di căn bạch huyết
Di căn hạch bạch huyết (LNM) là một đặc điểm phổ biến của hầu hết các khối u ác tính rắn và đóng vai trò là cơ sở quan trọng cho giai đoạn và tiên lượng bệnh. Hơn nữa, sự xâm nhập của các tế bào khối u trong các hạch bạch huyết dẫn đến khả năng dung nạp miễn dịch của khối u, tạo điều kiện thuận lợi cho di căn xa và tiến triển bệnh. Do đó, giải quyết LNM có ý nghĩa tối quan trọng để nâng cao tiên lượng của bệnh nhân ung thư.
Trong bối cảnh LNM, bóc tách hạch bạch huyết có hai chức năng chính. Đầu tiên, nó ngăn ngừa tái phát bằng cách loại bỏ các tổn thương khối u trong các hạch bạch huyết dẫn lưu khối u (tdln). Thứ hai, nó cung cấp thông tin chính xác cho việc lập giai đoạn, chẩn đoán, điều trị và dự đoán tiên lượng của bệnh nhân ung thư. 265.456 Những tác động này ảnh hưởng tích cực đến sự tái phát, di căn và sống sót của khối u. Xạ trị, một phương thức điều trị quan trọng cho các khối u di căn thấp, đã mang lại lợi ích rõ rệt cho bệnh nhân LNM. Một nghiên cứu thuần tập lớn của Cavano và cộng sự đã chứng minh rằng 90% bệnh nhân mắc LNM đã trải qua SBRT một cách an toàn và dung nạp tốt, dẫn đến tỷ lệ kiểm soát và sống sót tại chỗ cao. 457 Trong số những bệnh nhân bị ung thư biểu mô mũi họng và LNM mang tai, những người được xạ trị điều chỉnh cường độ đến các hạch bạch huyết mang tai cho thấy kết quả sống sót vượt trội so với những người có hạch bạch huyết mang tai được bảo tồn. Tuy nhiên, bệnh nhân ung thư đang điều trị miễn dịch nên thận trọng khi dự tính can thiệp phẫu thuật hoặc xạ trị, vì cắt bỏ hạch bạch huyết có khả năng phá vỡ cấu trúc và chức năng miễn dịch của vật chủ, do đó làm suy giảm phản ứng miễn dịch chống khối u và có khả năng làm cho liệu pháp miễn dịch không hiệu quả. 459.460 Hơn nữa, các phương pháp điều trị tại chỗ như phẫu thuật và xạ trị thường không đủ để giải quyết LNM tiềm ẩn. Do đó, bắt buộc phải điều tra tiềm năng của liệu pháp điều trị miễn dịch hoặc nhắm mục tiêu cho các hạch bạch huyết để kiểm soát LNM hiệu quả hơn.
Hình thành mạch bạch huyết đóng một vai trò quan trọng trong việc tạo điều kiện cho sự lan tỏa tế bào khối u đến các hạch bạch huyết,265 khiến nó trở thành một chiến lược điều trị đầy hứa hẹn cho LNM. Thụ thể C kinase 1 được kích hoạt đã được chứng minh là thúc đẩy quá trình hình thành bạch huyết trong cơ thể thông qua các cơ chế phụ thuộc vào galectin-1461 và kích hoạt con đường truyền tín hiệu AKT / mTOR glycolytic. Do đó, điều này tạo điều kiện thuận lợi cho sự phát triển của ung thư cổ tử cung LNM. Ngoài ra, nhắm mục tiêu các enzym liên quan đến các con đường chuyển hóa lipid cụ thể đại diện cho một con đường đầy hứa hẹn để phát triển các chiến lược điều trị mới để điều trị ung thư cổ tử cung LNM. 463 Trong một nghiên cứu gần đây, Mei và cộng sự đã chứng minh rằng 7-dehydrocholesterol reductase (DHCR7) đóng một vai trò quan trọng trong việc thúc đẩy LNM bằng cách kích hoạt con đường tín hiệu KANK4 / PI3K / AKT và tăng cường bài tiết VEGF-C. Những phát hiện này xác nhận thêm rằng DHCR7 là một mục tiêu điều trị tiềm năng mới. 464 Sterol O-acyltransferase 1 (SOAT1), được biểu hiện quá mức trong ung thư dạ dày, thúc đẩy tổng hợp lipid, gây ra hình thành bạch huyết và thúc đẩy ung thư dạ dày LNM bằng cách điều chỉnh tăng biểu hiện VEGF-C. Do đó, SOAT1 có thể đóng vai trò như một mục tiêu điều trị tiềm năng. 465 Các RNA không mã hóa cụ thể có thể xuất hiện như những mục tiêu tiềm năng để ức chế quá trình hình thành bạch huyết, điều này có thể chứng minh là một chiến lược hiệu quả để phòng ngừa và điều trị LNM. Các MicroRNA như miR-182-5p, miR-431-5p và RNA tròn NFIB1 và VESTAR, có thể ức chế sự hình thành bạch huyết khối u bằng cách điều chỉnh biểu hiện VEGF. 466.467.468.469
Việc ức chế di căn bạch huyết có thể đạt được bằng cách nhắm mục tiêu trực tiếp vào các tế bào ung thư. Trong ung thư biểu mô tế bào vảy đầu và cổ, sự im lặng của biểu hiện protein liên kết RING1 và YY1470 và kích hoạt trục tín hiệu Wnt / β-catenin / Slug471 góp phần vào sự xâm lấn và di chuyển của tế bào ung thư. Trong ung thư thanh quản, sự im lặng của HOXC6 ức chế EMT, khả năng tồn tại, di chuyển và xâm lấn của các tế bào ung thư thanh quản, do đó ức chế LNM ung thư thanh quản. 472 Li và cộng sự đã chứng minh rằng MEOX1 thúc đẩy LNM trong ung thư buồng trứng bằng cách điều chỉnh nhiều quá trình sinh học, bao gồm tăng sinh, EMT, hình thành bạch huyết và tái tạo ECM. Những phát hiện này cho thấy MEOX1 có thể đóng vai trò là một dấu ấn sinh học tiềm năng để chẩn đoán và điều trị ung thư buồng trứng LNM. 473 Trong ung thư dạ dày, RPRD1B thúc đẩy sự hấp thu và tổng hợp axit béo, cũng như LNM thông qua việc kích hoạt trục c-Jun / c-Fos / SREBP1. Điều này làm nổi bật RPRD1B như một mục tiêu tiềm năng để điều trị LNM ung thư dạ dày. 474
Các chiến lược điều trị nhắm mục tiêu vào di căn khối u thể hiện các con đường sáng tạo trên nhiều lớp và kích thước. Những tiến bộ này bao gồm một loạt các cách tiếp cận, từ các cuộc tấn công chính xác vào các tế bào ung thư di căn đến điều chỉnh phức tạp của TME phức tạp, đỉnh cao là các phương pháp điều trị cá nhân hóa phù hợp với di căn cơ quan cụ thể (Bảng 4). Mỗi tiến bộ minh họa sự hiểu biết sâu sắc về sinh học khối u và cách tiếp cận điều trị chính xác. Với những tiến bộ liên tục trong nghiên cứu cơ bản và công nghệ, các liệu pháp nhắm mục tiêu này sẽ tiếp tục được tinh chỉnh và tích hợp, cung cấp cho bệnh nhân ung thư các phác đồ điều trị hiệu quả hơn, an toàn hơn và phù hợp hơn. Tóm lại, sự tiến triển này hứa hẹn sẽ kéo dài đáng kể tỷ lệ sống sót của bệnh nhân và nâng cao QOL.
Các công nghệ trị liệu mới nổi
Sự tiến bộ nhanh chóng của khoa học và công nghệ đã tạo điều kiện thuận lợi cho việc áp dụng nhiều công nghệ mới nổi trong nghiên cứu và điều trị di căn khối u. Các phương pháp tiên tiến này nâng cao hiệu quả điều trị, giảm thiểu tác dụng phụ và đưa ra các giải pháp cá nhân hóa và chính xác cho sự phức tạp của ung thư di căn (Bảng 5). Tiến bộ này mang lại hy vọng và tiềm năng mới cho việc điều trị di căn khối u.
Công nghệ nano và vật liệu nano
Trong những năm gần đây, việc ứng dụng công nghệ nano trong y học, đặc biệt là trong điều trị di căn khối u, đã thu hút sự chú ý đáng kể. Vật liệu nano, với các đặc tính và khả năng đặc biệt của chúng, đưa ra những con đường mới để phát hiện sớm, chẩn đoán và điều trị di căn khối u. Vật liệu nano có thể được sử dụng làm chất cản quang để nâng cao độ phân giải và độ nhạy của kỹ thuật hình ảnh, do đó cải thiện độ chính xác của việc phát hiện di căn khối u. 475.476 Hệ thống phân phối thuốc nhắm mục tiêu dựa trên vật liệu nano sử dụng các hạt nano biến đổi bề mặt để liên kết có chọn lọc với các tế bào khối u, tạo điều kiện giải phóng thuốc chính xác và nâng cao hiệu quả. 477.478 Cách tiếp cận này giải quyết những hạn chế của các phương pháp điều trị truyền thống, bao gồm tính chọn lọc kém và độc tính cao. Vật liệu nano có tiềm năng xây dựng một nền tảng chẩn đoán và điều trị tích hợp, từ đó đồng bộ hóa chẩn đoán và điều trị bệnh, đồng thời nâng cao hiệu quả y tế và hiệu quả điều trị. 479.480 Việc ứng dụng công nghệ nano đã thúc đẩy nghiên cứu rõ rệt về sự tương tác phức tạp giữa TME, trao đổi chất và các can thiệp điều trị, do đó tạo điều kiện cho sự phát triển của các chiến lược điều trị sáng tạo. Một số vật liệu nano có thể giải phóng thuốc chống khối u để đáp ứng với các điều kiện cụ thể như pH, nhiệt độ và hoạt động của enzyme trong TME. 481.482.483 Hơn nữa, vật liệu nano có khả năng cản trở sự xâm lấn và di căn của tế bào khối u bằng cách ảnh hưởng đến sự kết dính của tế bào và tái tạo ma trận, trong số các cơ chế khác. 484.485.486 Hơn nữa, vật liệu nano có thể được kết hợp với các chiến lược điều trị như liệu pháp miễn dịch và xạ trị để tạo điều kiện cho hiệu quả của liệu pháp kết hợp. 480.487.488.489 Các vật liệu và kỹ thuật nano mới đã dẫn đến kỳ vọng rằng công nghệ nano sẽ tạo điều kiện cho những tiến bộ chuyển đổi trong điều trị ung thư. Tuy nhiên, bắt buộc phải nhấn mạnh sự an toàn sinh học, tác dụng lâu dài và tác dụng phụ tiềm ẩn của vật liệu nano. 490
Công nghệ chỉnh sửa gen
Công nghệ chỉnh sửa gen, đặc biệt là CRISPR / Cas9, đã nâng cao đáng kể nghiên cứu khoa học đời sống, mang lại hứa hẹn to lớn cho việc thúc đẩy y học khối u chính xác. 491.492.493 Trong bối cảnh di căn khối u, chỉnh sửa gen có khả năng ức chế sự phát triển và di căn của khối u bằng cách loại bỏ hoặc sửa chữa các gen ung thư và gen đột biến. 494.495.496 Hơn nữa, chỉnh sửa gen có thể xác định và mô tả các gen liên quan đến di căn khối u, có thể cung cấp các mục tiêu điều trị tiềm năng cho các phương pháp điều trị chống di căn khối u. 497.498 Hơn nữa, chỉnh sửa gen tạo điều kiện thuận lợi cho việc xác định các gen chịu trách nhiệm cho kháng thuốc khối u, do đó cung cấp các mục tiêu tiềm năng để giải quyết thách thức đáng kể này trong điều trị ung thư. 499.500 Hơn nữa, nó có thể thay đổi sự biểu hiện của các tế bào hoặc phân tử trong TME, do đó ức chế sự xâm lấn và di căn của khối u. 501.502.503 Ngoài việc chỉnh sửa gen trực tiếp, việc áp dụng vật liệu sinh học nano và các chiến lược phân phối đáp ứng kích thích cung cấp các phương pháp tiếp cận sáng tạo để nâng cao hiệu quả chỉnh sửa gen và kiểm soát chính xác việc giải phóng,504,505 do đó giảm thiểu độc tính và tác dụng phụ. Tuy nhiên, công nghệ chỉnh sửa gen vẫn phải đối mặt với những thách thức đáng kể, bao gồm đảm bảo tính đặc hiệu và an toàn, tránh các tác động ngoài mục tiêu, và giải quyết các mối quan tâm về đạo đức và pháp lý. 506.507
Vắc-xin ung thư
Vắc-xin ung thư, kích thích phản ứng miễn dịch chống khối u hiệu quả bằng cách kích hoạt hệ thống miễn dịch và tế bào miễn dịch, có khả năng ức chế sự phát triển và di căn của khối u. 508 Các loại vắc-xin này có thể được phân thành hai loại chính: vắc-xin dự phòng và vắc-xin điều trị. Ngoài ra, chúng có thể được phân biệt thêm dựa trên thành phần hoặc chất mang của chúng, bao gồm vắc-xin khối u toàn bào, 509 vắc-xin kháng nguyên khối u, 510 vắc-xin peptide, 511 vắc-xin RNA, 512 vắc-xin DNA, 513 vắc-xin tế bào đuôi gai, 514.515 vắc-xin nano, 516 vắc-xin tại chỗ, 517.518 và vắc-xin nano vi khuẩn. 519 Sự tích hợp của công nghệ nano, 520.521 vật liệu sinh học, 522 và công nghệ chỉnh sửa gen, 523 trong số các kỹ thuật khác, có khả năng giảm hơn nữa tác dụng ngoài mục tiêu và tăng cường phản ứng miễn dịch chống khối u, do đó mở rộng phạm vi điều trị di căn khối u. Vắc-xin ung thư có thể tạo điều kiện thuận lợi cho sự kết hợp các kháng nguyên trong các hạch bạch huyết, do đó tăng cường trình bày kháng nguyên và bắt đầu phản ứng miễn dịch chống khối u hiệu quả. 524.525.526.527 Hơn nữa, vắc-xin ung thư có thể trực tiếp kích hoạt các tế bào miễn dịch, từ đó tạo ra khả năng miễn dịch chống khối u. 528 Hơn nữa, những loại vắc-xin này có thể tăng cường hiệu quả của việc phá hủy tế bào khối u bằng cách điều chỉnh các cơ chế ức chế miễn dịch. 513.529.530 Việc phát triển vắc-xin dựa trên kháng nguyên tế bào khối u cụ thể từ từng bệnh nhân cho phép phương pháp điều trị cá nhân hóa. 509.531 Hơn nữa, vắc-xin ung thư với hình ảnh trực quan và theo dõi thời gian thực đang phát triển nhanh chóng, tạo điều kiện cho sự hiểu biết sâu sắc hơn về cơ chế và nguyên tắc của vắc-xin in vivo. Điều này nâng cao hiệu quả của vắc-xin ung thư. 525.532 Tuy nhiên, vắc-xin ung thư phải đối mặt với một số thách thức, bao gồm trốn tránh miễn dịch của tế bào khối u, tối ưu hóa thiết kế vắc-xin và ức chế miễn dịch của TME.
Trí tuệ nhân tạo
Các công nghệ trí tuệ nhân tạo (AI), bao gồm học máy và mạng nơ-ron nhân tạo, có thể được sử dụng để phân tầng nguy cơ khối u, phát hiện di căn và đáp ứng điều trị. Những công nghệ này đang được phát triển nhanh chóng để điều trị di căn khối u. 533.534.535 AI có tiềm năng nâng cao đáng kể độ chính xác và hiệu quả chẩn đoán của bác sĩ lâm sàng thông qua sự hỗ trợ phân tích hình ảnh y tế, do đó giảm thời gian chẩn đoán và giảm thiểu nguy cơ bỏ lỡ chẩn đoán. 536.537 Hơn nữa, AI có thể phân tích dữ liệu sinh học khổng lồ để dự đoán mục tiêu thuốc, từ đó đẩy nhanh quá trình phát triển các loại thuốc mới và giảm chi phí liên quan. 538.539 Hơn nữa, AI có thể xem xét kỹ lưỡng dữ liệu bộ gen và lâm sàng của bệnh nhân, tạo điều kiện xác định đột biến gen, đánh giá nguy cơ ung thư, phân tầng độ nhạy thuốc, dự đoán đáp ứng điều trị và mô hình tiên lượng, do đó cho phép y học chính xác. 540.541.542.543.544.545.546 Sự ra đời của các mô hình ngôn ngữ lớn, chẳng hạn như ChatGPT, được dự đoán sẽ tạo điều kiện thuận lợi cho việc ứng dụng AI tổng quát (GAI) trong một số lĩnh vực quan trọng, bao gồm viết tài liệu lâm sàng và quản lý dữ liệu,547,548,549,550 cũng như hỗ trợ quyết định lâm sàng551,552 và chăm sóc sức khỏe cá nhân. Tuy nhiên, một số thách thức vẫn cần được giải quyết, bao gồm khả năng giải thích AI, thiên vị dữ liệu và bảo vệ quyền riêng tư. 554
Tin sinh học
Tin sinh học là một lĩnh vực liên ngành dựa trên kiến thức từ sinh học, khoa học máy tính và toán học để giải quyết các vấn đề sinh học phức tạp. 555 Nó đóng một vai trò quan trọng trong nghiên cứu về di căn khối u. Tin sinh học có thể phân tích và giải thích một lượng lớn dữ liệu sinh học, đóng vai trò là nền tảng để khám phá các đặc điểm sinh học, cơ chế di căn và cơ chế điều hòa của di căn khối u. 556.557.558 Hơn nữa, tin sinh học tạo điều kiện thuận lợi cho việc khám phá và xác định các dấu ấn sinh học tiềm năng để chẩn đoán sớm, theo dõi điều trị và đánh giá tiên lượng di căn khối u. 559.560 Bằng cách kiểm tra các đặc điểm phân tử của tế bào ung thư, tin sinh học có thể xác định các mục tiêu điều trị mới tiềm năng có thể cung cấp thông tin cho việc thiết kế và tối ưu hóa các loại thuốc chống ung thư mới. 561.562.563.564 Hơn nữa, tin sinh học có thể tích hợp dữ liệu bộ gen, phiên mã và protein của bệnh nhân với dữ liệu phản ứng điều trị và hình ảnh y tế. 565 Cách tiếp cận tích hợp này cung cấp một tài liệu tham khảo có giá trị để xây dựng các kế hoạch điều trị cá nhân hóa. Tuy nhiên, việc ứng dụng tin sinh học cũng gặp phải những thách thức, bao gồm chất lượng và tính sẵn có của dữ liệu, chú thích thông tin chính xác, tính công bằng và cân nhắc đạo đức. 566.567.568
Những thách thức khi nghiên cứu di căn ung thư
Lỗ hổng kiến thức trong việc hiểu về di căn khối u
Sự lan truyền của di căn đặt ra một số câu hỏi quan trọng, đặc biệt là liên quan đến thời gian của quá trình này. Người ta cho rằng sự lan tỏa có thể bắt đầu trong giai đoạn đầu của sự tiến triển của khối u, với sự hình thành PMN không có triệu chứng xảy ra ở giai đoạn này. Giai đoạn sớm và thường không thể phát hiện này đặt ra những thách thức cho chẩn đoán lâm sàng và can thiệp sớm, do đó làm phức tạp các nghiên cứu về PMN trong mẫu bệnh nhân ở người. Do đó, rất khó để hiểu những tiến bộ trong kiến thức của chúng ta về PMN có thể chuyển thành lợi ích lâm sàng cho điều trị ung thư như thế nào.
Các phân tích bộ gen gần đây và các thí nghiệm truy tìm dòng dõi đã tiết lộ rằng nhiều di căn tiến hóa thông qua con đường di căn đến di căn. 68.569.570.571.572.573 Trong di căn xương, Zhang và cộng sự phát hiện ra rằng các khối u di căn đến xương tăng cường khả năng thân và di căn của chúng thông qua các biến đổi biểu sinh. Tuy nhiên, các nghiên cứu toàn diện so sánh các thay đổi phiên mã, biểu sinh và di truyền giữa các tế bào khối u từ di căn nguyên phát và thứ phát vẫn còn thiếu. Hạn chế này phát sinh do các phương pháp hiện tại không thể phân biệt đáng tin cậy nguồn gốc tế bào của CTC, cho dù từ các hoạt động phẫu thuật trong quá trình tiêm dòng tế bào, di căn nguyên phát hoặc di căn tiến triển hơn nữa.
Hiện tượng vận động cơ quan di căn, cùng với việc quan sát di căn từ di căn sang di căn, chỉ ra rằng sự tiến triển của khối u xảy ra cùng với sự tiến hóa của mô vật chủ. Một loại ung thư duy nhất có thể di căn sang các mô khác nhau, trong khi các loại ung thư khác nhau có thể di căn đến cùng một cơ quan. Tuy nhiên, có rất ít nghiên cứu toàn diện so sánh các hệ sinh thái di căn trên các mô khác nhau từ cùng một loại ung thư hoặc các loại ung thư khác nhau di căn sang cùng một cơ quan. Một số nhóm nghiên cứu đã xác định được khoảng cách kiến thức này và tập trung vào việc mô tả sự đồng tiến hóa giữa khối u và vật chủ. Ví dụ, Xu và cộng sự đã phân tích toàn diện TME di căn ung thư phổi ở các cơ quan khác nhau, bao gồm xương, gan và não. Tương tự, Liu và cộng sự đã kiểm tra các nguyên mẫu miễn dịch đa dạng của di căn xương do các loại ung thư khác nhau xâm nhập. Cả hai nghiên cứu đều sử dụng giải trình tự tế bào đơn, nhấn mạnh sự cần thiết phải phân tích thông lượng cao rộng rãi hơn. Việc lập hồ sơ như vậy có thể nâng cao hiểu biết của chúng ta về tín hiệu tế bào-tế bào và tương tác miễn dịch-khối u trong TME di căn, làm sáng tỏ cơ chế hướng nội tạng và cung cấp thông tin cho các phương pháp điều trị di căn tiềm năng. Những nghiên cứu này rất quan trọng để phát triển các biện pháp can thiệp sớm để ngăn ngừa di căn, xác định dấu ấn sinh học cho tiên lượng và điều chỉnh các liệu pháp cá nhân hóa để cải thiện kết quả của bệnh nhân. Sự thiếu hụt sàng lọc thông lượng cao của TME di căn là do một số yếu tố. Việc thiết lập di căn tự phát đặc hiệu của cơ quan trong các mô hình chuột là một thách thức vì thiếu các mô hình lý tưởng giúp loại bỏ ảnh hưởng của các can thiệp phẫu thuật và đáp ứng miễn dịch quá mức đối với các thẻ dòng tế bào. Hơn nữa, các mô hình di căn in vivo vốn rất khó kiểm soát. Thu thập các mẫu nguyên phát và di căn phù hợp từ bệnh nhân là một thách thức đáng kể, đặc biệt là với tính chất xâm lấn của các thủ tục liên quan và sự cần thiết phải phối hợp giữa các hệ thống chăm sóc sức khỏe đa dạng. Hơn nữa, bệnh nhân trải qua các thủ thuật phẫu thuật thường gây ra các hiệu ứng hàng loạt đáng kể, điều này có thể làm phức tạp việc phân tích và giải thích dữ liệu.
Kỹ thuật giải trình tự tế bào đơn đã được sử dụng rộng rãi trong các nghiên cứu về TME. Tuy nhiên, di căn khối u là động, với động học tế bào và phân tử đáng kể không ngừng phát triển. Các mẫu hồ sơ từ một thời điểm cụ thể chỉ cung cấp một phần đại diện của toàn bộ quá trình di căn. Mặc dù có sẵn các công cụ phân tích phức tạp, chẳng hạn như một mắt 3577,578,579,580 và vận tốc RNA,581,582 tạo điều kiện cho việc ước tính sự chuyển đổi trạng thái tế bào ở độ phân giải cao trong các điều kiện thí nghiệm, những kỹ thuật này vẫn không đủ để nắm bắt đầy đủ quỹ đạo dòng dõi thực tế. Độ chính xác của suy luận quỹ đạo là một thách thức để đánh giá, do các sự kiện lập trình lại rộng rãi xảy ra trong TME. Hơn nữa, tiền xử lý dữ liệu của bộ dữ liệu đơn tế bào có khả năng loại bỏ các quần thể tế bào hiếm, điều này có thể dẫn đến các phân tích bị sai lệch bởi các quần thể tế bào trội.
Những trở ngại của di căn ung thư trong các thử nghiệm lâm sàng
Thử nghiệm lâm sàng là một thành phần không thể thiếu trong quá trình thu thập bằng chứng điều trị chất lượng cao và đánh giá hiệu quả và an toàn của các loại thuốc chưa được liệt kê. Chúng đóng vai trò quan trọng trong việc đẩy nhanh sự phát triển của các loại thuốc di căn chống khối u, từ đó đáp ứng nhu cầu của bệnh nhân ung thư. Tuy nhiên, các thử nghiệm lâm sàng phải đối mặt với vô số thách thức cản trở việc thu thập bằng chứng y tế vượt trội và ảnh hưởng sâu sắc đến chẩn đoán và điều trị di căn khối u.
Thiết kế thử nghiệm
Các thử nghiệm ngẫu nhiên có đối chứng vẫn là tiêu chuẩn vàng để đánh giá phác đồ điều trị và hiệu quả trong di căn khối u, cung cấp bằng chứng mạnh mẽ để phát triển các phác đồ điều trị lâm sàng. 584.585.586 Các chiến lược điều trị khối u đặc hiệu cho cơ quan đã mang lại kết quả điều trị đáng chú ý ở nhiều loại khối u. Thành công này đã thúc đẩy thiết kế nhiều thử nghiệm lâm sàng dựa trên các khối u nguyên phát để đạt được hiệu quả tối ưu. Tuy nhiên, các khối u di căn thường thể hiện sự phức tạp hơn so với các khối u nguyên phát, khiến phác đồ điều trị dựa trên khối u nguyên phát không hiệu quả trong bối cảnh bệnh di căn. 380.587 Các phác đồ điều trị đặc biệt phù hợp với các đặc điểm của di căn đã cho thấy kết quả thuận lợi. 387 Một ví dụ như vậy là việc sử dụng các chất điều chỉnh xương để điều trị di căn xương. Hơn nữa, trước những khó khăn gặp phải khi cố gắng đạt được hiệu quả điều trị tối ưu với phương pháp điều trị đơn lẻ, liệu pháp kết hợp ngày càng trở thành trọng tâm chính của điều trị di căn khối u. 588 Do đó, các thử nghiệm lâm sàng được thiết kế tốt nhắm vào các đặc điểm đặc biệt của di căn khối u nên được tiến hành để nâng cao hiệu quả ở bệnh nhân di căn khối u và thu được bằng chứng y tế dựa trên bằng chứng chất lượng cao.
Sự không đồng nhất của khối u
Bản chất không đồng nhất của các khối u là hậu quả của áp lực chọn lọc do TME gây ra. Các tế bào khối u nguyên phát và tế bào di căn ở xa thể hiện các quá trình trao đổi chất khác biệt, phản ứng miễn dịch, tốc độ tăng trưởng và các đặc điểm khác góp phần chung vào sự không đồng nhất của khối u. 589 Hiện tượng này là một chỉ số quan trọng về sự tiến triển của ung thư. 590.591 Sự không đồng nhất của khối u làm tăng tính xâm lấn của tế bào ung thư và thúc đẩy khả năng kháng thuốc, đây là một yếu tố quan trọng trong sự phát triển của kháng thuốc. 589.592.593.594 Liệu pháp nhắm mục tiêu đại diện cho một chiến lược để giải quyết tình trạng kháng thuốc trong tế bào ung thư; tuy nhiên, nó cũng dễ bị kháng thuốc. 379.380.587.595.596 Kết quả của các thử nghiệm lâm sàng đã tiết lộ sự khác biệt đáng chú ý về hiệu quả của phác đồ điều trị khi dùng cho các phân nhóm bệnh nhân có hồ sơ di truyền khác nhau. 585.593 Điều này chỉ ra rằng một lý do quan trọng cho sự thất bại của liệu pháp nhắm mục tiêu đối với di căn khối u có thể là do liệu pháp nhắm mục tiêu dựa trên biểu hiện gen đặc biệt của khối u nguyên phát hơn là tế bào ung thư di căn. 597.598 Do đó, khi tiến hành các thử nghiệm lâm sàng về điều trị di căn khối u, các nhà nghiên cứu bắt buộc phải xem xét tính không đồng nhất của khối u và sử dụng các phương pháp dựa trên dấu ấn sinh học để xác định các nhóm nhỏ bệnh nhân đáp ứng với dược phẩm nhắm mục tiêu, từ đó tối ưu hóa kết quả điều trị. 599
Các yếu tố phi thử nghiệm
Trong bối cảnh thử nghiệm lâm sàng, các nhà điều tra phải xem xét vô số yếu tố phi thử nghiệm, bao gồm thành phần của nhóm nghiên cứu, sự sẵn có của nguồn lực bệnh nhân, hạn chế tài chính, khả năng tiếp cận thiết bị và các quy định đạo đức hiện hành. Nếu những yếu tố này không được quản lý hiệu quả, chúng có thể cản trở việc tiến hành tiêu chuẩn của các thử nghiệm lâm sàng. Sự sẵn có của các nguồn lực bệnh nhân là điều kiện tiên quyết cho nghiên cứu lâm sàng. Việc thực hiện thành công các thử nghiệm lâm sàng phụ thuộc vào việc ghi danh bệnh nhân đủ điều kiện và đạt được kích thước và quy mô mẫu cụ thể. 600.601.602.603 Hơn nữa, chi phí tài chính đáng kể liên quan đến việc tiến hành các thử nghiệm này là một yếu tố quan trọng. Một số lượng đáng kể các thử nghiệm lâm sàng đòi hỏi cơ sở hạ tầng tốn kém để tạo điều kiện thuận lợi cho các nghiên cứu của họ. Do đó, khả năng áp dụng kết luận của họ phụ thuộc vào hiệu quả chi phí. 605 Các tổ chức và quốc gia khác nhau hợp tác để giảm chi phí và đẩy nhanh việc tuyển dụng bệnh nhân ngày càng trở nên phổ biến. 585 Hơn nữa, việc thiếu nhân viên chuyên môn, không đủ thiết bị, thời gian quay vòng kéo dài và sự khác biệt trong các quy định đạo đức có thể cản trở việc tiến hành các thử nghiệm lâm sàng thích hợp. 601.606 Do đó, các nhà nghiên cứu phải xem xét và quản lý các yếu tố phi thử nghiệm này trong quá trình thiết kế và thực hiện các thử nghiệm lâm sàng để thúc đẩy việc thực hiện các thử nghiệm lâm sàng bình thường, an toàn và có trật tự.
Kết luận và định hướng trong tương lai
Trong những thập kỷ gần đây, những tiến bộ đáng kể đã được thực hiện trong nghiên cứu di căn khối u, đặc biệt là trong các bệnh ác tính. Các nhà nghiên cứu đã làm sáng tỏ các cơ chế phức tạp và nhấn mạnh vai trò quan trọng của TME như một chất điều chỉnh quan trọng trong quá trình năng động này. Từ sự điều chế phức tạp của các con đường tín hiệu tế bào đến sự tương tác phức tạp trong ECM và động lực học tế bào và phân tử phức tạp trên các cơ quan chủ khác nhau, tất cả đều đã được xác định là yếu tố chính ảnh hưởng đến di căn khối u. Các đặc điểm cụ thể của di căn đa cơ quan, bao gồm phổi, gan, não và xương, cùng với các cơ chế phân tử cơ bản của chúng, đã nâng cao hơn nữa sự hiểu biết toàn diện của chúng ta về bối cảnh di căn khối u. Các thử nghiệm lâm sàng gần đây không chỉ làm sâu sắc hơn sự hiểu biết của chúng ta về mối quan hệ phức tạp giữa di căn khối u, đặc điểm khối u nguyên phát, đáp ứng điều trị và kết quả của bệnh nhân mà còn thúc đẩy sự phát triển và áp dụng các chiến lược đa dạng nhắm vào các con đường tín hiệu cụ thể và các mục tiêu điều trị sáng tạo. Những nỗ lực này đã nâng cao hiệu quả của các can thiệp điều trị và có khả năng kéo dài thời gian sống sót của bệnh nhân và cải thiện QOL. Cần nghiên cứu thêm để hiểu sâu hơn về các cơ chế mà TME ảnh hưởng đến di căn khối u. Cần kiểm tra toàn diện các tương tác phức tạp giữa các khối u và các mô vật chủ, cơ quan, tế bào miễn dịch, mạng lưới mạch máu và các thành phần vi môi trường khác để xác định các mục tiêu điều trị mới và chiến lược can thiệp. Đồng thời, chúng tôi tìm cách có được những hiểu biết sâu sắc ở cấp độ phân tử về toàn bộ quá trình di căn khối u bằng cách áp dụng các công nghệ tin sinh học, bộ gen và proteomics tiên tiến, do đó cho phép theo dõi và can thiệp chính xác hơn trong sự tiến triển của bệnh. Khi dữ liệu tích lũy và công nghệ tiến bộ với tốc độ chưa từng có, tầm nhìn về y học cá nhân hóa ngày càng trở nên hiện thực. Việc thực hiện phác đồ điều trị tùy chỉnh dựa trên hồ sơ di truyền cá nhân, mô hình biểu hiện protein và các dấu ấn sinh học khác sẽ tạo điều kiện phù hợp chính xác hơn với nhu cầu điều trị của bệnh nhân, từ đó nâng cao hiệu quả điều trị đồng thời giảm thiểu tác dụng phụ. Sự thay đổi mô hình trong phương thức điều trị này chắc chắn mang lại hy vọng cho bệnh nhân ung thư, báo trước một kỷ nguyên mới của điều trị khối u. Tóm lại, một nghiên cứu toàn diện và chuyên sâu về di căn khối u đã hiểu sâu hơn về các quá trình sinh học phức tạp của nó và đặt nền tảng vững chắc cho việc phát triển các chiến lược điều trị hiệu quả và cá nhân hóa hơn. Những nỗ lực này có khả năng nâng cao đáng kể tỷ lệ sống sót và QOL của bệnh nhân, từ đó góp phần vào sáng kiến toàn cầu để vượt qua thách thức sức khỏe ghê gớm này.

