Bệnh học UNG THƯ ứng dụng machine learning – AI trong phân tích
- Amelie Echle ,
- Niklas Timon Rindtorff ,
- Titus Josef Brinker ,
- Tom Luedde ,
- Alexander Thomas Pearson &
- Jakob Nikolas Kather
Tạp chí Ung thư Anh ( 2020 ) Trích dẫn bài báo này
- 1833 Quyền truy cập
- 31 Altmetric
- Số liệuchi tiết
trừu tượng
Quy trình công việc lâm sàng trong ung thư học dựa trên các dấu ấn sinh học phân tử tiên lượng và tiên lượng. Tuy nhiên, số lượng ngày càng tăng của các dấu ấn sinh học phức tạp này có xu hướng làm tăng chi phí và thời gian cho việc ra quyết định trong thực hành chuyên khoa ung thư hàng ngày; hơn nữa, các dấu ấn sinh học thường yêu cầu mô khối u nằm trên vật liệu chẩn đoán thông thường. Tuy nhiên, các mô khối u có sẵn thông thường chứa rất nhiều thông tin liên quan đến lâm sàng mà hiện chưa được khai thác đầy đủ. Những tiến bộ trong học tập sâu (DL), một công nghệ trí tuệ nhân tạo (AI), đã cho phép trích xuất thông tin ẩn trước đây trực tiếp từ hình ảnh mô học thông thường của ung thư, cung cấp thông tin hữu ích về mặt lâm sàng. Đây, chúng tôi phác thảo các khái niệm mới nổi về cách DL có thể trích xuất các dấu ấn sinh học trực tiếp từ hình ảnh mô học và tóm tắt các nghiên cứu về phân tích hình ảnh cơ bản và nâng cao cho mô học ung thư. Các nhiệm vụ phân tích hình ảnh cơ bản bao gồm phát hiện, phân loại và phân loại mô khối u trong hình ảnh mô học; chúng nhằm mục đích tự động hóa quy trình làm việc bệnh lý và do đó không chuyển ngay thành các quyết định lâm sàng. Vượt lên trên các cách tiếp cận cơ bản như vậy, DL cũng đã được sử dụng cho các nhiệm vụ phân tích hình ảnh nâng cao, có khả năng ảnh hưởng trực tiếp đến quá trình ra quyết định lâm sàng. Các phương pháp tiếp cận tiên tiến này bao gồm suy luận về các đặc điểm phân tử, dự đoán khả năng sống sót và dự đoán cuối cùng về đáp ứng điều trị. Các dự đoán được thực hiện bởi các hệ thống DL như vậy có thể đơn giản hóa và phong phú hóa việc ra quyết định lâm sàng,
Lý lịch
Các quy trình ra quyết định trong ung thư học ngày nay không còn dựa vào các quy trình làm việc tuyến tính và đơn giản; thay vào đó, với sự sẵn có của số lượng ngày càng tăng của các dấu ấn sinh học, các sơ đồ này giống như những cái cây phức tạp với nhiều nhánh, do đó làm tăng sự phức tạp của các khuyến nghị điều trị đối với các khối u rắn. Các dấu ấn sinh học phân tử được sử dụng hiện nay trong các quy trình làm việc về ung thư này có thể mang tính tiên lượng hoặc tiên lượng. Các dấu ấn sinh học tiên lượng cho phép phân loại bệnh nhân theo nguy cơ tiến triển hoặc tử vong của bệnh và do đó, có thể được sử dụng để điều chỉnh cường độ điều trị cho từng bệnh nhân. Ví dụ, trong ung thư đại trực tràng giai đoạn II (CRC), sự không ổn định của tế bào vi mô (MSI) là một dấu ấn sinh học tiên lượng; nếu MSI được phát hiện,1 Ngược lại, các dấu ấn sinh học dự đoán cho phép lựa chọn một phương pháp điều trị nhắm mục tiêu cụ thể cho một nhóm bệnh nhân cụ thể. Ví dụ, trong CRC giai đoạn IV khó điều trị, MSI là dấu ấn sinh học được FDA chấp thuận cho liệu pháp miễn dịch dựa trên điểm kiểm soát-chất ức chế miễn dịch. 2 Trong trường hợp này, việc phát hiện MSI tương quan với khả năng đáp ứng điều trị tích cực, làm cho MSI trở thành dấu ấn sinh học dự đoán mạnh mẽ trong cài đặt này. Tương tự, trong ung thư vú, việc phát hiện HER2 dương tính 3 làm cho bệnh nhân đủ điều kiện để điều trị bằng các chất chống HER2, do đó hoạt động như một dấu ấn sinh học dự đoán mạnh mẽ trong bệnh này. 4 Việc lựa chọn phương pháp điều trị ung thư phổi không phải tế bào nhỏ (NSCLC) bị ảnh hưởng bởi một số lượng lớn các dấu ấn sinh học phân tử,5 với đột biến gây ung thư trong gen mã hóa thụ thể yếu tố tăng trưởng biểu bì (EGFR) và các gen khác, hợp nhất gen của kinase u lympho không sản sinh (ALK) hoặc các trình điều khiển khác và sự biểu hiện quá mức của phối tử tế bào chết được lập trình 1 (PD-L1) 6 là một phần của bảng phân tử tiêu chuẩn chăm sóc cần thiết để điều trị thường quy bệnh tiến triển hoặc di căn. 7 Do đó, rõ ràng là số lượng ngày càng tăng nhanh chóng và tầm quan trọng lâm sàng của các dấu ấn sinh học phân tử trong thực hành lâm sàng thường quy cho phép các phương pháp điều trị ung thư được điều chỉnh cụ thể hơn tùy theo cấu tạo di truyền của một khối u cụ thể; do đó, tuy nhiên, chi phí, thời gian quay vòng và các yêu cầu về mô trong quy trình công việc thường xuyên cũng tăng lên. 8 , 9
Việc thiết kế các thử nghiệm lâm sàng cho các tác nhân điều trị mới trong các khối u rắn ngày càng đi đôi với các dấu ấn sinh học tiên đoán. Ngoài các tính năng phân tử phổ biến cao, nhiều thử nghiệm Giai đoạn 2 và 3 được thực hiện trong ~ 5 năm qua đã tập trung vào các quần thể phân tử phân tử hiếm gặp của các khối u rắn, chẳng hạn như những khối u có MSI, 10 thiếu sót sửa chữa tương đồng 11 và các khối u hợp nhất trong ung thư các loại. 12 , 13 , 14Như đã đề cập ở trên, MSI được sử dụng như một dấu ấn sinh học dự đoán cho liệu pháp miễn dịch, trong khi các khối u thiếu khả năng sửa chữa tương đồng có thể nhắm mục tiêu một cách hiệu quả bởi các chất ức chế poly ADP-ribose polymerase (PARP), và các khối u hướng hợp nhất đáp ứng đặc biệt tốt với liệu pháp nhắm mục tiêu phân tử. Tuy nhiên, với tỷ lệ phổ biến của các kiểu gen này nằm trong khoảng từ 1% đến 10% trong các quần thể trong thế giới thực, việc sàng lọc những người tiềm năng cho những thử nghiệm này là tốn kém và bị cản trở bởi sự sẵn có hạn chế của các xét nghiệm phân tử. Vì vậy, mặc dù số lượng các dấu ấn sinh học tiên lượng và tiên lượng ngày càng tăng cho phép điều trị bệnh nhân ung thư có nhiều sắc thái hơn, sự phức tạp của quá trình ra quyết định lâm sàng ngày càng trở thành một vấn đề trong việc tuyển dụng thử nghiệm lâm sàng và thường quy.
Mặc dù hầu hết các dấu ấn sinh học mới trong ung thư học đều dựa trên các xét nghiệm sinh học phân tử, nhưng những tiến bộ trong học sâu (DL) đang tạo điều kiện thuận lợi cho việc trích xuất thông tin ẩn trực tiếp từ dữ liệu có sẵn thông thường. DL là một phương pháp trong lĩnh vực trí tuệ nhân tạo (AI) sử dụng mạng thần kinh nhân tạo để xác định các mẫu lặp lại trong các tập dữ liệu phức tạp. Dữ liệu hình ảnh nói riêng có mật độ thông tin cao, lý tưởng cho việc phân tích bằng các kỹ thuật DL.
Thật vậy, phân tích hình ảnh dựa trên DL có các ứng dụng rộng rãi trong nhiều lĩnh vực y học hiện đại liên quan đến dữ liệu hình ảnh: trong X quang, DL thực hiện các nhiệm vụ lặp đi lặp lại với hiệu suất giống người hoặc siêu người, chẳng hạn như phát hiện khối u hoặc phân đoạn cơ quan trên chụp cắt lớp vi tính (CT) hình ảnh. Cho đến nay, hơn một chục phương pháp DL được FDA chấp thuận để sử dụng lâm sàng trong X quang — ví dụ, phân tích dựa trên DL của dữ liệu CT đã được thực hiện trong một thử nghiệm tầm soát ung thư phổi năm 2019, 15 và bằng chứng về tính hữu ích lâm sàng của những phương pháp này. các phương pháp được lắp nhanh chóng. Dữ liệu hình ảnh cộng hưởng từ (MRI), chứa nhiều thông tin hơn dữ liệu CT, cũng có thể sử dụng để khai thác dựa trên DL, 16và DL cũng đã cho thấy kết quả mạnh mẽ cho các nhiệm vụ không phải X quang như phân tích hình ảnh nội soi thời gian thực 17 , 18 và phát hiện ung thư da trong hình ảnh nội soi da. 19 , 20Tuy nhiên, so với các phương thức hình ảnh này, mô học là nguồn hình ảnh phổ biến với mật độ thông tin đáng chú ý có thể thu được từ thực hành lâm sàng thường quy. Lớn hơn nhiều so với hình ảnh X quang xét về điểm ảnh, hình ảnh từ các trang chiếu mô học mang nhiều thông tin hơn: hàng triệu tế bào khác nhau có thể được nhìn thấy trong một trang chiếu mô học và hình thái và sự sắp xếp không gian của chúng mang nhiều thông tin hơn các hình ảnh y học khác. Ngay cả kích thước của tập dữ liệu CT toàn bộ ngực cũng không gần bằng kích thước của tập dữ liệu từ một hình ảnh toàn bộ mô học được lấy từ khối u của cùng một bệnh nhân khi được đo bằng pixel (Hình 1a, b ). Mật độ thông tin cao này làm cho hình ảnh mô học trở thành một nguồn hấp dẫn để khai thác dấu ấn sinh học dựa trên DL.
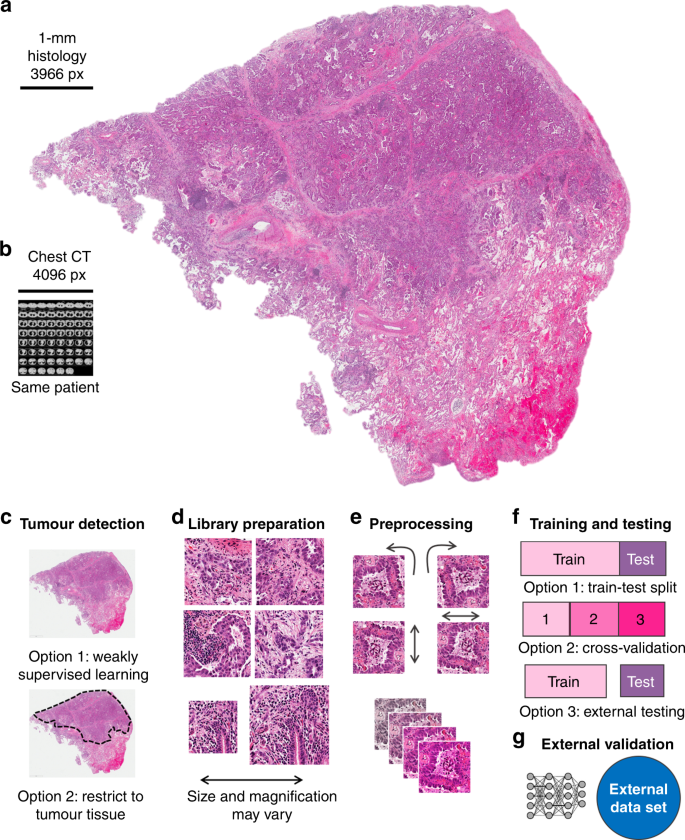
một hình ảnh mô học thường xuyên của bệnh ung thư phổi (từ The Cancer Genome Atlas (TCGA) và The Cancer Imaging Lưu Trữ (TCIA)). b So sánh kích thước (tính theo pixel) của chụp CT ngực của cùng một bệnh nhân. c Đường ống xử lý hình ảnh đồng thuận. Đầu tiên, toàn bộ trang trình bày hoặc chỉ vùng khối u được ghép thành các ô hình ảnh nhỏ hơn. d Những ô này bao gồm một thư viện hình ảnh, tương tự như thư viện chuẩn bị (prep.) trong giải trình tự bộ gen. e Các ô được xử lý trước để đạt được hằng số quay và tăng cường tập dữ liệu. fCác bộ phân loại học sâu được phát triển và triển khai bằng cách tách nhóm bệnh nhân thành một nhóm đào tạo và thử nghiệm, bằng cách sử dụng xác nhận chéo hoặc bằng cách có sẵn nhiều nhóm để đào tạo và thử nghiệm. g Tốt nhất, một tập dữ liệu bên ngoài bổ sung được sử dụng để xác thực bộ phân loại kết quả.
Với bài báo này, chúng tôi mong muốn có một cái nhìn tổng quan rõ ràng về các ứng dụng DL trong lĩnh vực mô học ung thư bằng cách phân loại và so sánh các nghiên cứu dựa trên DL từ quan điểm lâm sàng. Sau đó, các trường hợp sử dụng có thể xảy ra và các bước tiếp theo cần thiết trên con đường sử dụng có lợi trong môi trường lâm sàng sẽ được thảo luận.
Phân tích hình ảnh mô học dựa trên học sâu
Trong quá trình chẩn đoán bệnh nhân có khối u rắn, mẫu mô thường được lấy bằng sinh thiết hoặc bằng phẫu thuật cắt bỏ, sau đó là chuẩn bị bệnh lý và trong hầu hết các trường hợp, nhuộm bằng haematoxylin và eosin (H&E). Do đó, các slide H&E thường xuyên có sẵn cho hầu hết mọi bệnh nhân ung thư, làm cho chúng trở thành nguồn dữ liệu dễ lấy, giàu thông tin để đánh giá bằng phương pháp DL, cũng giải thích trọng tâm của các nghiên cứu trước đây về các loại hình ảnh này. Tuy nhiên, DL là một công cụ có khả năng ứng dụng trong các loại vết bẩn mô học khác nhau, chẳng hạn như hóa mô miễn dịch (IHC) 21 hoặc axit-Schiff định kỳ. 22
Các bước xử lý hình ảnh
Kích thước dữ liệu tuyệt đối của hình ảnh mô học toàn trang được quét đặt ra những thách thức thực tế cho việc phân tích hình ảnh dựa trên DL. Kích thước tệp lớn của chúng không cho phép chúng được tải hoàn toàn vào bộ nhớ của các đơn vị xử lý đồ họa (GPU), khối công việc của DL. Hơn nữa, hình ảnh mô học thường chứa rất nhiều mô không phải khối u, làm loãng nội dung thông tin tổng thể. Để đối phó với những hình ảnh lớn và không đồng nhất như vậy, cần phải xử lý trước nhiều hình ảnh; do đó, một đường ống phân tích hình ảnh đồng thuận đã được tạo ra. Phân tích từng bước này bao gồm tessellation (Hình 1d ), xử lý trước các ô hình ảnh (Hình 1e ) và đào tạo và thử nghiệm mạng DL, còn được gọi là bộ phân loại DL (Hình 1f), sau đó có thể được áp dụng cho các nhóm xác thực bên ngoài (Hình 1g ). Thuật ngữ “trình phân loại” đề cập đến bất kỳ chương trình máy tính nào — sau khi được đào tạo về một tập hợp các ví dụ — sau đó có thể phân loại dữ liệu tương tự. Trong phân tích hình ảnh mô học, bộ phân loại có thể phân loại các mảng hình ảnh nhỏ là “khối u” hoặc “không phải khối u” hoặc nó có thể phân loại bệnh nhân là “người phản ứng tiềm năng” hoặc “người không đáp ứng tiềm năng”. Trong số tất cả các bộ phân loại, mạng DL đang nổi lên như một công nghệ được sử dụng rộng rãi nhất và mạnh mẽ nhất.
Các ứng dụng cơ bản và nâng cao của DL trong mô học ung thư
Sau các quy trình tiền xử lý chuẩn hóa, hình ảnh mô học có thể được sử dụng cho một loạt các ứng dụng DL. Quy trình công việc DL sử dụng một nhóm huấn luyện bệnh nhân để dự đoán một nhãn được xác định trước từ dữ liệu hình ảnh. Các nghiên cứu trước đây đã khám phá nhiều nhãn khác nhau, từ dự đoán sự hiện diện của mô khối u xâm lấn trong mô tuyến tiền liệt, 23 , 24 , 25 đến xác định kiểu gen khối u trực tiếp từ hình ảnh mô học. 26 , 27 Ở đây, chúng tôi đề xuất rằng các loại nhãn này được phân biệt trên cơ sở sử dụng chúng trong các ứng dụng DL cơ bản hoặc nâng cao (Hình bổ sung 1 ).
Các ứng dụng DL cơ bản nhằm mục đích đơn giản hóa quy trình công việc thường ngày hoàn toàn do các nhà nghiên cứu bệnh học thực hiện. Ví dụ nổi bật là việc phát hiện mô khối u trong các mẫu sinh thiết hoặc phân loại khối u dựa trên hình thái học, chẳng hạn như chấm điểm Gleason của các mẫu ung thư tuyến tiền liệt. Trong trường hợp thứ hai, giá trị số của điểm Gleason được dùng làm nhãn để đào tạo hệ thống DL. Các ứng dụng DL cơ bản này có khả năng làm giảm chi phí và thời gian quay vòng trong các khoa bệnh lý, nhưng không thay đổi kết quả cuối cùng mà bác sĩ lâm sàng đưa ra các khuyến nghị điều trị.
Mặt khác, các ứng dụng DL tiên tiến vượt ra ngoài báo cáo tiêu chuẩn hiện đang được thực hiện bởi các nhà bệnh lý học. Một ví dụ là dự đoán đột biến di truyền và khả năng sống sót trực tiếp từ các slide mô nhuộm H & E. Trong trường hợp đột biến gen, nhãn hình ảnh là kiểu gen được xác định trong quá trình chẩn đoán thông thường bằng cách sử dụng xét nghiệm sinh học phân tử hoặc các xét nghiệm tiêu chuẩn vàng khác như là phương pháp xác thực. “Sự thật cơ bản” đề cập đến loại xét nghiệm được sử dụng để gắn nhãn hình ảnh trong quá trình đào tạo. Do đó, bộ phân loại DL có thể được đào tạo để tái tạo “sự thật cơ bản” (còn được gọi là “phương pháp tiêu chuẩn vàng”) chỉ bằng cách phân tích dữ liệu hình ảnh mô học. Không giống như các ứng dụng DL cơ bản, 1 ).
Do đó, DL là một công cụ mạnh mẽ để trích xuất thông tin từ hình ảnh mô học của các khối u rắn và có thể được sử dụng để tự động hóa quy trình công việc hiện tại hoặc cung cấp thông tin bổ sung hiện không được sử dụng trong quy trình làm việc lâm sàng. Trong vài phần tiếp theo, chúng tôi sẽ tóm tắt hiện trạng của các ứng dụng cơ bản và nâng cao của DL trong phân tích hình ảnh mô học ung thư.
Các ứng dụng cơ bản của DL: phát hiện khối u, phân loại và phân loại
Nói chung, mọi mẫu khối u đặc đều phải trải qua quá trình phân tích chi tiết bởi một nhà bệnh lý học được đào tạo, người xác nhận sự hiện diện của mô khối u và cung cấp thêm thông tin như cấp và loại phụ của mẫu khối u ở tay. Trong lĩnh vực của các nhiệm vụ chẩn đoán cơ bản nhưng quan trọng đó, DL đã cho thấy tiềm năng hữu ích để tự động hóa các nhiệm vụ lặp đi lặp lại trong chẩn đoán bệnh lý.
Tự động hóa quy trình làm việc mô bệnh học bằng DL
Trong nhiều năm, các ấn phẩm về bệnh học kỹ thuật số đã mô tả và cải tiến lặp đi lặp lại các nhiệm vụ phân tích hình ảnh cơ bản như phát hiện khối u, 28 phân loại khối u, 29 định lượng số lượng tế bào 30 và phân loại các loại tế bào. 31Điểm chung của các cách tiếp cận này là phương pháp cơ bản-sự thật và hệ thống DL sử dụng cùng một dữ liệu hình ảnh làm đầu vào cho dự đoán của chúng. Ví dụ, sự hiện diện của mô khối u xâm lấn trong các mẫu sinh thiết ung thư tuyến tiền liệt thường được đánh giá từ các slide mô nhuộm H & E bởi một nhà nghiên cứu bệnh học. Hệ thống DL cơ bản tóm tắt lại nhiệm vụ này và được đào tạo để dự đoán sự hiện diện của ung thư xâm lấn từ cùng một hình ảnh mô học H&E. Do đó, các máy phát hiện khối u dựa trên DL như vậy có thể tự động hóa các nhiệm vụ tẻ nhạt thường được thực hiện thủ công.
Nhiều nghiên cứu, được xác định bởi một truy vấn tìm kiếm xác định trước trên cơ sở dữ liệu MEDLINE như được hiển thị trong Phương pháp Bổ sung, đã chứng minh tính mạnh mẽ của các phương pháp phát hiện khối u dựa trên DL như vậy trên một loạt các loại khối u, như được tóm tắt trong Bảng 1 và Hình 2a. Hiệu suất phân loại, nghĩa là bộ phân loại DL dự đoán điểm cuối được chỉ định trước tốt như thế nào, thường được đo bằng diện tích dưới đường cong vận hành máy thu (AUROC) và máy phát hiện khối u dựa trên DL thường đạt được giá trị AUROC> 0,99, cho thấy sự phù hợp gần như đầy đủ kết quả từ các nhà nghiên cứu bệnh học và mạng lưới DL. Các vấn đề phân tích hình ảnh cơ bản tiềm năng khác liên quan đến việc tổng hợp lại việc phát hiện và phân loại khối u dựa trên các đặc điểm mô học. Ví dụ, hệ thống Gleason là chỉ dấu sinh học hình thái học phù hợp nhất được sử dụng để phân tầng bệnh nhân trong ung thư tuyến tiền liệt. Việc phân loại Gleason thường được thực hiện thủ công bởi các chuyên gia nghiên cứu bệnh học dựa trên các slide mô H&E, nhưng hệ thống DL đã được áp dụng thành công để tự động hóa công việc này. 23Tương tự như vậy, việc phân loại NSCLC thành ung thư biểu mô tuyến hoặc ung thư biểu mô tế bào vảy có liên quan đến lâm sàng và được thực hiện một cách nhanh chóng và nhanh chóng bởi các nhà nghiên cứu bệnh học chuyên gia và hệ thống DL. 26
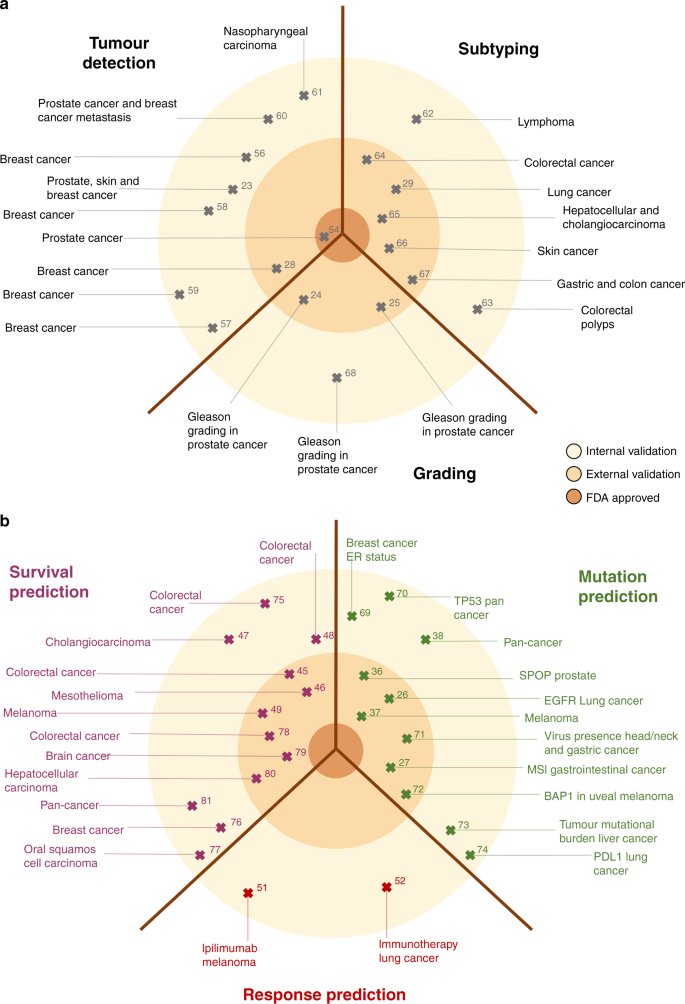
Bệnh lý DL có thể được áp dụng để phát hiện khối u và xác định loại phụ (ứng dụng cơ bản) hoặc để dự đoán các đặc điểm lâm sàng quan tâm (ứng dụng nâng cao). Các nghiên cứu đã công bố (được chỉ ra bởi số tham chiếu) được phân loại theo mức độ bằng chứng (đơn trung tâm (được phê duyệt nội bộ), đa trung tâm (được phê duyệt bên ngoài) hoặc được FDA chấp thuận). a Các nhiệm vụ phân tích hình ảnh cơ bản, bao gồm phát hiện, phân loại và phân loại khối u. bCác nhiệm vụ phân tích hình ảnh nâng cao, bao gồm những nhiệm vụ vượt quá khả năng thông thường của bác sĩ bệnh học, chẳng hạn như dự đoán đột biến, tiên lượng và phản ứng. Trí tuệ nhân tạo AI, ung thư phổi không tế bào nhỏ NSCLC, hình ảnh toàn bộ WSI, thụ thể ER estrogen, tính không ổn định của vi tế bào MSI, đường tiêu hóa GI, protein BTB / POZ loại đốm SPOP, protein liên kết BAP1 BRCA 1, đầu và cổ HNSCC ung thư biểu mô tế bào vảy, ung thư biểu mô đường mật CCA.
Tuy nhiên, cuối cùng, các hệ thống DL cơ bản để phát hiện, phân loại và phân loại khối u chỉ được các bác sĩ lâm sàng quan tâm hạn chế vì chúng không thay đổi thực hành lâm sàng trong ung thư học. So với các nhà nghiên cứu bệnh học chuyên gia, các hệ thống như vậy có thể giảm chi phí hoặc thời gian quay vòng, nhưng chỉ trong một số trường hợp hiếm hoi, chúng mới cải thiện độ nhạy và độ đặc hiệu so với các nhà quan sát chuyên gia của con người. Do đó, mặc dù các hệ thống DL cơ bản có thể mang lại những thay đổi sâu sắc trong cách thực hành bệnh lý, nhưng theo quan điểm của bác sĩ ung thư, chúng không thay đổi ngay lập tức quy trình làm việc lâm sàng và khuyến nghị điều trị cho bệnh nhân ung thư.
Xác nhận cấp độ lâm sàng của các phương pháp DL cơ bản
Phần thách thức nhất của việc phát triển các hệ thống DL cơ bản trong bệnh lý kỹ thuật số là xác nhận lâm sàng của chúng. Việc chỉ sử dụng một tập dữ liệu duy nhất để phát triển và xác thực phương pháp có nguy cơ trang bị quá mức, dẫn đến việc tạo ra một hệ thống DL hoạt động tốt trong nhóm bệnh nhân cụ thể đó, nhưng không tổng quát hóa cho các nhóm bên ngoài. Tương ứng, việc xác nhận hệ thống DL trong các bộ dữ liệu bên ngoài, lý tưởng là bộ dữ liệu đa trung tâm, là điều tối quan trọng đối với việc sử dụng thường xuyên và phê duyệt theo quy định. Trong 2 năm qua, ngày càng có nhiều nghiên cứu quy mô lớn, đa trung tâm về các hệ thống DL cơ bản. Ví dụ, ba nghiên cứu độc lập đã chứng minh hệ thống DL để phát hiện và phân loại ung thư tuyến tiền liệt với hiệu suất cấp nhà bệnh học và xác nhận bên ngoài trong các nhóm bệnh nhân lớn. 23 ,24 , 25 Một điểm mấu chốt để loại bỏ những nỗ lực quy mô lớn này là hiệu suất của hệ thống DL tăng lên cùng với số lượng bệnh nhân trong nhóm đào tạo, đạt mức ổn định về hiệu suất sau khi đào tạo trên 10.000–15.000 hình ảnh toàn bộ slide mô học, 23 mà cho thấy nhu cầu về lượng hình ảnh và dữ liệu to lớn khi hướng tới sự phát triển của các hệ thống DL hoạt động tốt. Những nỗ lực này phản ánh các nghiên cứu quốc tế quy mô lớn bằng cách sử dụng các phương thức hình ảnh khác, chẳng hạn như chụp nhũ ảnh. 32 Vì vậy, đối với các tác vụ nhận dạng hình ảnh đơn giản, hệ thống DL có thể giảm bớt khối lượng công việc cho các chuyên gia con người trong tương lai gần.
Các ứng dụng nâng cao: dự đoán đột biến, sống sót và phản ứng từ mô học
Vượt xa các ứng dụng cơ bản của DL trong phân tích hình ảnh mô học
Hệ thống DL có thể tiếp cận hiệu suất của con người trong việc phát hiện, phân loại và phân loại khối u, nhưng hình ảnh mô học chứa rất nhiều thông tin hiện chưa được khai thác một cách có hệ thống để hướng dẫn các quyết định điều trị trong ung thư học. Như chúng ta sẽ thảo luận trong các phần sau, lượng thông tin phong phú này đã được chứng minh bởi một số nghiên cứu đã sử dụng DL để suy ra các nhãn cấp cao trực tiếp từ ảnh H&E. Các chuyên gia về con người quan sát hình ảnh mô học không thể suy ra một cách đáng tin cậy các nhãn cấp cao này, mà cần phải có các phương pháp khác ngoài mô bệnh học thông thường. Đặc biệt, ngày càng tập trung vào việc dự đoán các nhãn liên quan đến lâm sàng trực tiếp từ mô học trong ba lĩnh vực chính: suy luận về sự thay đổi gen, dự đoán khả năng sống sót và dự đoán đáp ứng điều trị (Bảng 2và Hình 2b ). Tương tự như nghiên cứu trong lĩnh vực rộng hơn của bệnh học kỹ thuật số, nghiên cứu trong ba ứng dụng chính của DL đã phát triển nhanh chóng trong vài năm qua (Hình bổ sung 2a, b ). Không giống như các kỹ thuật phân tích hình ảnh cơ bản, những ứng dụng tiên tiến này của DL để phân tích hình ảnh mô học có khả năng thay đổi trực tiếp việc ra quyết định lâm sàng trong việc quản lý các khối u đặc. Ở đây, chúng tôi xem xét tình trạng hiện tại của bệnh lý DL có thể áp dụng lâm sàng và tác động của nó đối với quy trình làm việc lâm sàng cũng như thiết kế và tuyển dụng thử nghiệm lâm sàng.
Dự đoán kiểu gen và biểu hiện gen
Các đột biến trình điều khiển gây ung thư thay đổi các tế bào bình thường thành các tế bào ung thư ác tính, tua lại bộ máy tế bào và thay đổi cơ bản hành vi của tế bào. 33 , 34 Theo đó, những đột biến trình điều khiển di truyền như vậy tạo ra những thay đổi về hình thái của tế bào ung thư, chẳng hạn như kết cấu, kích thước và hình dạng hạt nhân và tế bào trong một hình ảnh mô học. Hơn nữa, các tế bào ác tính cũng có thể gây ra phản ứng ở các tế bào không ác tính lân cận như nguyên bào sợi và tế bào lympho, dẫn đến những thay đổi hình thái bậc hai trong mô khối u trên quy mô micromet hoặc milimet. 35Mặc dù mỗi đặc điểm hình thái gây ra bởi các đột biến trình điều khiển gây ung thư đơn lẻ có thể rất tinh vi, nhưng các nghiên cứu đã chỉ ra rằng những thay đổi này có thể được phát hiện một cách đáng tin cậy bởi DL. Thật vậy, chỉ đơn thuần quan sát các mẫu hình thái này trong ảnh H&E cho phép dự đoán trực tiếp kiểu gen của các gen riêng lẻ từ các ảnh mô học thông thường. Nghiên cứu dựa trên DL có hệ thống đầu tiên trong lĩnh vực này đã chứng minh kiểu gen ung thư được phản ánh như thế nào trong kiểu hình mô học của ung thư biểu mô tuyến phổi (Bảng 2 và Hình 2b ): Coudray và các đồng nghiệp đã chỉ ra rằng, cũng như việc phát hiện và phân loại tự động các khối u, cụ thể đột biến gen, bao gồm cả những đột biến trong serine / threonine kinase 11 ( STK11 ), protein khối u p53 ( TP53) và thụ thể yếu tố tăng trưởng biểu bì ( EGFR ) có thể được dự đoán chỉ từ mô học, với giá trị AUROC đạt tới 0,85, mà họ đã xác nhận trong một nhóm thuần tập bên ngoài. 26 Một nghiên cứu khác chỉ ra rằng kiểu gen của protein BTB / POZ loại đốm ung thư ( SPOP ) có thể được dự đoán từ hình ảnh nhuộm H & E của ung thư tuyến tiền liệt, mặc dù hiệu suất phân loại giảm. 36 Tương tự, trong u ác tính, tình trạng đột biến gen sinh ung thư NRAS (NRAS) và gen sinh ung thư B-Raf (BRAF) có thể dự đoán trực tiếp từ hình ảnh H&E. 37
Dự đoán tình trạng đột biến của các gen này có liên quan đến liệu pháp nhắm mục tiêu. Trong ung thư phổi, kiểu gen của EGFR hướng dẫn việc điều trị bằng nhiều chất ức chế tyrosine kinase (TKI) của EGFR đột biến.protein và trong khối u ác tính, BRAF đột biến có thể nhắm mục tiêu trực tiếp với chất ức chế serine / threonine kinase. Do đó, việc phát hiện các đột biến trong các gen này trực tiếp từ mô học thường quy có thể có ý nghĩa rộng rãi đối với quy trình làm việc lâm sàng. Một ví dụ khác có liên quan đến lâm sàng liên quan đến liệu pháp miễn dịch ung thư. MSI, tương quan di truyền của sự thiếu hụt sửa chữa không phù hợp (dMMR), là một trong số ít các dấu ấn sinh học di truyền được FDA chấp thuận để sử dụng liệu pháp ức chế điểm kiểm soát miễn dịch và là dấu ấn duy nhất áp dụng cho bất kỳ loại ung thư nào. MSI gây ra một sự thay đổi hình thái mạnh mẽ trong khối u và môi trường vi mô của nó, và có thể được phát hiện một cách đáng tin cậy chỉ từ mô học trong ung thư dạ dày, đại trực tràng và nội mạc tử cung. 27Nhiều nghiên cứu đã xác nhận những phát hiện này cũng như mở rộng kiểu gen dựa trên DL cho một loạt các đột biến và dấu hiệu biểu hiện gen khác trên nhiều loại khối u (Bảng 2 và Hình 2b ). Các nghiên cứu được công bố trong 1–2 năm qua đã theo đuổi phương pháp tiếp cận “đột biến pan-ung thư” để cố gắng dự đoán bất kỳ thay đổi di truyền nào trong bất kỳ loại khối u rắn nào trực tiếp từ mô học H&E. 38 , 39 , 40 Tuy nhiên, những nghiên cứu này chủ yếu dựa trên một tập dữ liệu cụ thể, “Bản đồ bộ gen ung thư (TCGA)”, được cung cấp bởi Viện Ung thư Quốc gia (NCI), và do đó, việc xác nhận quy mô lớn trong các nhóm thuần tập đặc trưng gen ngoài TCGA là cần thiết để đánh giá mức độ mạnh mẽ của các phương pháp này trong các ứng dụng ung thư toàn thân.
Hiện tại, việc phát hiện bất kỳ thay đổi di truyền nào trong mô khối u trong quy trình lâm sàng đều yêu cầu các xét nghiệm phòng thí nghiệm ướt, chẳng hạn như IHC, lai tại chỗ (ISH), phản ứng chuỗi polymerase (PCR) hoặc giải trình tự thế hệ tiếp theo (NGS), được thực hiện song song với quy trình đánh giá các mẫu mô học, chẳng hạn như phân loại và phân loại khối u. Mặc dù các xét nghiệm trong phòng thí nghiệm ướt này khác nhau về độ nhạy và độ đặc hiệu, chúng có chung một số nhược điểm: chúng có xu hướng tốn kém và mất thời gian và không có sẵn ở mọi điểm chăm sóc ung thư. Ngược lại, đánh giá dựa trên DL đối với các slide mô học đã quét thường xuyên không phát sinh bất kỳ chi phí hoặc thời gian đáng kể nào và có thể được triển khai ngay cả trên phần cứng di động. 39Tuy nhiên, đáng chú ý, trong tất cả các nghiên cứu dựa trên DL được thực hiện cho đến nay, hiệu suất (được đo lường bởi AUROC) đã thay đổi theo kích thước mẫu của nhóm huấn luyện và sức mạnh kiểu hình của mục tiêu di truyền cụ thể, nhưng luôn thấp hơn các thử nghiệm trong phòng thí nghiệm ướt tiêu chuẩn vàng (Bảng 1 ). Tuy nhiên, những tiến bộ công nghệ và đào tạo về bộ dữ liệu lớn hơn được kỳ vọng sẽ thúc đẩy hiệu suất. Hơn nữa, ngay cả các xét nghiệm dựa trên DL không hoàn hảo cũng có thể được sử dụng để sàng lọc trước cho bệnh nhân về sự thay đổi gen quan tâm, như sẽ được thảo luận dưới đây.
Dự đoán sự sống sót thông qua các dấu ấn sinh học DL
Ở hầu hết các nhánh của cây quyết định điều trị trong ung thư, nguy cơ tái phát hoặc tử vong phải được tính đến. Ví dụ, đối với bệnh nhân ung thư đại trực tràng giai đoạn II hoặc III (CRC), nguy cơ tái phát cao cung cấp lý do để thực hiện hóa trị bổ trợ sau phẫu thuật, 41 và đối với CRC giai đoạn IV, nguy cơ tử vong cao có thể khiến bác sĩ ung thư và bệnh nhân lựa chọn một liệu pháp toàn thân tích cực hơn so với liệu pháp hiện được khuyến nghị trong các hướng dẫn. 42Hiện tại, khả năng sống sót được ước tính bằng các thông số lâm sàng như tuổi, giới tính, giai đoạn ung thư, tình trạng bệnh từ trước, biến đổi gen và các yếu tố nguy cơ mô học. Các yếu tố nguy cơ mô học này, rất phong phú, bao gồm biệt hóa tế bào khối u, sự phong phú về mô đệm, phân đoạn tế bào lympho, xâm lấn mạch bạch huyết, xâm lấn mạch máu, xâm lấn màng phổi và hoại tử ở hầu hết mọi loại khối u đặc. Ngoài các yếu tố rủi ro đã được thiết lập này, các tính năng cấp cao hơn mang thông tin tiên lượng. Ví dụ, phân tích sự sắp xếp không gian của các tế bào lympho cho thấy tỷ lệ bạch cầu trung tính trên tế bào lympho cao có liên quan đến khả năng sống sót tổng thể không thuận lợi, 43 hoặc việc kiểm tra các đặc điểm dưới hình ảnh như kết cấu nhiễm sắc có thể là một chỉ báo tiên lượng trong các khối u rắn khác nhau. 44DL có thể tích hợp tất cả các đặc điểm nhìn thấy được và nhìn thấy trực tiếp từ dữ liệu hình ảnh để dự đoán khả năng sống sót, như đã được chỉ ra trong một số nghiên cứu (Hình 2a ). Điều thú vị là, trong khi một số nghiên cứu đã sử dụng các thông số được xác định trước theo cách thủ công để huấn luyện mạng DL cho các yếu tố dự đoán sự sống sót, 45 nghiên cứu khác đã sử dụng cách tiếp cận không thiên vị và để việc lựa chọn tính năng hoàn toàn cho mạng sâu, 46 , 47 có nghĩa là không có thông số tiên lượng nào, chẳng hạn như loại mô hoặc các khía cạnh tế bào, được xác định hoặc chiết xuất thủ công trong quá trình này. Cả hai cách tiếp cận vẫn cần được xác nhận một cách độc lập và khách quan để cuối cùng làm cơ sở cho các chiến lược điều chỉnh rủi ro trong bối cảnh lâm sàng.
Một số nghiên cứu quan trọng đã khám phá dự đoán sống sót dựa trên DL ở một số loại ung thư. Bychkov và cộng sự. cho thấy rằng có thể dự đoán thời gian sống thêm 5 năm theo bệnh cụ thể của bệnh nhân CRC chỉ sử dụng vi vi mô nhuộm H & E. 48 Tương tự, sự cải thiện của dự đoán sống sót, so với các phương pháp hiện đại, đã được chứng minh ở bệnh nhân CRC bằng dự đoán OS thông qua phân loại mô. 45
Courtiol và cộng sự. dự đoán OS trong một nhóm lớn bệnh nhân bị u trung biểu mô ác tính và các đặc điểm mô học được hình dung liên quan đến thời gian sống sót dài hoặc ngắn được xác định bởi mạng DL. 46 Đồng thời, tỷ lệ sống sót theo bệnh cụ thể được ước tính bằng dự đoán dựa trên DL về sự phát triển tái phát di căn xa ở những bệnh nhân bị u ác tính nguyên phát. 49Đây là một ví dụ điển hình cho thấy có thể đào tạo mạng DL trên các điểm cuối lâm sàng trực tiếp từ mô học. Hơn nữa, quá trình này thậm chí có thể tiết lộ các dấu ấn sinh học hình thái học mới bằng cách làm nổi bật các cấu trúc và vùng cụ thể. Trong tương lai, kỹ thuật đảo ngược các tính năng có liên quan này thậm chí có thể hữu ích trong việc xác định các mục tiêu để phát triển các liệu pháp mới. Tuy nhiên, cho đến nay, chỉ có một số ít các công bố đã phát triển và thảo luận về ý nghĩa lâm sàng của dự đoán sống sót dựa trên DL từ mô học thường quy (Bảng 2 và Hình 2b). Đặc biệt, vẫn chưa có nghiên cứu nào có điểm cuối lâm sàng kết hợp dự đoán thời gian sống sót DL vào quy trình làm việc lâm sàng, mặc dù các thử nghiệm tiền cứu lớn đã đánh giá điểm cuối lâm sàng bằng các dấu ấn sinh học tiên lượng khác như việc sử dụng OncotypeDX trong thử nghiệm TAILORx về ung thư vú; 50 mức độ bằng chứng này vẫn còn thiếu trong tài liệu DL.
Dự đoán phản hồi đầu cuối trực tiếp từ mô học
Số lượng các lựa chọn có sẵn cho liệu pháp nhắm mục tiêu cho các loại ung thư không ngừng tăng lên. Tuy nhiên, hầu hết các liệu pháp đó chỉ có hiệu quả ở một số ít bệnh nhân và vẫn có thể gây ra tác dụng phụ đáng kể ở những người không đáp ứng. Một ví dụ điển hình là liệu pháp miễn dịch ung thư, mặc dù nó đã thay đổi hoàn toàn bối cảnh điều trị cho khối u ác tính và ung thư phổi, vẫn có thể khiến khoảng một nửa số bệnh nhân mắc các loại khối u này không có phản ứng có ý nghĩa. DL có thể là chìa khóa để phát hiện các cấu trúc và biến đổi trong mô khối u có thể được sử dụng làm dấu hiệu dự đoán phản ứng tích cực đối với các liệu pháp nhắm mục tiêu và do đó giúp xác định những người đáp ứng trong khi giảm thiểu tác động tiêu cực lên những người không đáp ứng.
Có thể hình dung được hai cách tiềm năng để áp dụng DL vào hình ảnh mô học thông thường để phát hiện / xác định các dấu hiệu dự báo dương tính. Đầu tiên, DL có thể xác định các đặc điểm, đột biến, trạng thái thụ thể hormone hoặc các thay đổi phân tử tương tự đã được biết đến là mục tiêu của các phương pháp tiếp cận liệu pháp hoặc proxy để đáp ứng điều trị. Với DL có khả năng tiết kiệm thời gian và chi phí, phương pháp này có thể giúp chỉ định bệnh nhân vào chế độ trị liệu tối ưu nhanh hơn và chính xác hơn. Ngoài ra, DL có thể được sử dụng để dự đoán đáp ứng điều trị trực tiếp từ slide mô học mà không cần được đào tạo để phát hiện các dấu ấn sinh học phân tử cụ thể được xác định trước. Quy trình công việc “end-to-end” này yêu cầu mạng DL phải được đào tạo trên các nhóm bệnh nhân lớn mà loại phản ứng điều trị cụ thể đã được biết đến. Bởi vì dữ liệu hình ảnh như vậy không dễ dàng có được, 2 và Hình 2b ). Đáng chú ý, Harder và các đồng nghiệp đã phân loại bệnh nhân u ác tính là người đáp ứng và người không đáp ứng với ipilimumab, 51 tuổi và Madabhushi et al. đã chứng minh một khái niệm để dự đoán đáp ứng với liệu pháp miễn dịch ở bệnh nhân NSCLC trực tiếp từ hình ảnh nhuộm H & E. 52 Tuy nhiên, những nghiên cứu này chỉ bao gồm một số lượng nhỏ bệnh nhân, và có thể mong đợi rằng tiềm năng của DL để dự đoán đáp ứng điều trị vẫn chưa hết. Tương tự như mạng lưới dự đoán tỷ lệ sống sót, dự đoán đáp ứng điều trị có thể dẫn đến việc phát hiện các dấu hiệu hình thái mới trên hình ảnh mô học, dẫn đến các chiến lược điều trị mới.
Triển khai các dấu ấn sinh học DL trong quy trình công việc lâm sàng
Dự đoán đột biến dựa trên DL để sàng lọc trước hoặc thử nghiệm xác định
Quy trình làm việc lâm sàng cho hầu hết mọi loại ung thư tiến triển chính đều dựa vào xét nghiệm phân tử để điều chỉnh điều trị cho phù hợp với cấu tạo phân tử của mô khối u; Tuy nhiên, những hạn chế thực tế đã loại trừ thử nghiệm phổ quát. Việc áp dụng định dạng gen dựa trên DL trong các quy trình công việc này gấp đôi: Dấu ấn sinh học DL có thể được sử dụng để sàng lọc trước cho bệnh nhân trước khi xét nghiệm di truyền hoặc cuối cùng có thể thay thế các phương pháp hiện tại để xét nghiệm dứt điểm, phương pháp sau yêu cầu hiệu suất xét nghiệm cao hơn nhiều so với mức đạt được cho đến nay. Hầu hết các nghiên cứu chứng minh khái niệm về DL để dự đoán đột biến đã báo cáo giá trị AUROC trong khoảng 0,70–0,90, tương đương với độ đặc hiệu là 50% ở độ nhạy 90–95%. Mặc dù hiệu suất này rõ ràng là thấp hơn so với yêu cầu của một thử nghiệm cuối cùng nó có thể hữu ích cho những bệnh nhân sàng lọc trước về những đặc điểm hiếm như hợp nhất với NTRK, chẳng hạn, thu hẹp dân số người mang mầm bệnh tiềm năng xuống 50% sẽ làm giảm tải lượng xét nghiệm phân tử cần thiết. Xem xét sự phát triển của DL trong bệnh lý kỹ thuật số, những tiến bộ công nghệ có thể được kỳ vọng sẽ thúc đẩy hiệu suất trong tương lai. Theo đó, ngày càng nhiều dấu ấn sinh học DL có thể vượt quá ngưỡng AUROC 0,90, chuyển thành các đặc tính và độ nhạy tương tự, hoặc thậm chí cao hơn, so với những gì hiện đang được mong đợi từ các xét nghiệm phân tử. Trong trường hợp này, các khái niệm DL có thể được coi là phương pháp thử nghiệm cuối cùng để phát hiện các đột biến trực tiếp từ các slide mô học. Xem xét sự phát triển của DL trong bệnh lý kỹ thuật số, những tiến bộ công nghệ có thể được kỳ vọng sẽ thúc đẩy hiệu suất trong tương lai. Theo đó, ngày càng nhiều dấu ấn sinh học DL có thể vượt quá ngưỡng AUROC 0,90, chuyển thành các đặc tính và độ nhạy tương tự, hoặc thậm chí cao hơn, so với những gì hiện đang được mong đợi từ các xét nghiệm phân tử. Trong trường hợp này, khái niệm DL có thể được coi là phương pháp thử nghiệm cuối cùng để phát hiện đột biến trực tiếp từ các slide mô học. Xem xét sự phát triển của DL trong bệnh lý kỹ thuật số, những tiến bộ công nghệ có thể được kỳ vọng sẽ thúc đẩy hiệu suất trong tương lai. Theo đó, ngày càng nhiều dấu ấn sinh học DL có thể vượt quá ngưỡng AUROC 0,90, chuyển thành các đặc tính và độ nhạy tương tự, hoặc thậm chí cao hơn, so với những gì hiện đang được mong đợi từ các xét nghiệm phân tử. Trong trường hợp này, khái niệm DL có thể được coi là phương pháp thử nghiệm cuối cùng để phát hiện đột biến trực tiếp từ các slide mô học.
Tiến tới sự chấp thuận lâm sàng: chúng ta đang ở đâu?
So với ứng dụng của nó trong lĩnh vực X quang, các ứng dụng của DL trong mô bệnh học chậm phát triển, nhưng bối cảnh nghiên cứu đang nhanh chóng chuyển từ hướng công nghệ sang các nghiên cứu liên quan đến lâm sàng, ngày càng tập trung nhiều hơn vào các vấn đề và nhiệm vụ có liên quan trực tiếp để ra quyết định lâm sàng và điều trị cho bệnh nhân. Song song đó, ngày càng có nhiều khái niệm DL nhận được sự chấp thuận từ các cơ quan quản lý và tìm đường đưa chúng vào ứng dụng lâm sàng, ví dụ, để phát hiện xuất huyết nội sọ trên chụp CT não hoặc xác định tràn khí màng phổi hoặc gãy xương sườn trên ảnh CT ngực. 53 Trong lĩnh vực phân tích hình ảnh mô bệnh học, các quy trình hiện tại được FDA chấp thuận chỉ giới hạn trong các ứng dụng DL cơ bản như phát hiện và phân loại khối u, 54nhưng các phương pháp phân tích hình ảnh tiên tiến có thể sẽ được chấp thuận lâm sàng trong vài năm tới. Tuy nhiên, việc triển khai thường quy các phương pháp DL vẫn còn bị cản trở bởi những hạn chế thực tế: thứ nhất, việc triển khai rộng rãi mô học DL vào thực hành lâm sàng sẽ đòi hỏi sự sẵn có rộng rãi của các máy quét slide và tiêu chuẩn hóa các định dạng tệp, điều này hiện khác xa so với thực hành thường quy trong chẩn đoán bệnh lý . Ngoài ra, các hệ thống DL sẽ phải được cải thiện hơn nữa về hiệu suất để trở thành các công cụ có thể sử dụng được trên lâm sàng; khi sử dụng hệ thống DL để sàng lọc trước, các dự đoán dương tính giả có thể được giảm thiểu bằng xét nghiệm phân tử tiếp theo, nhưng các dự đoán âm tính giả không thể được chấp nhận trong bối cảnh lâm sàng.
Ngoài việc là công cụ hữu ích tiềm năng cho thực hành lâm sàng thường quy trong ung thư học, hệ thống DL có thể hữu ích trong các thử nghiệm lâm sàng theo hai cách. Bằng cách sử dụng “hệ thống DL dự đoán đột biến”, nhóm thuần tập bệnh nhân lớn có thể được sàng lọc một cách không tốn kém cho một đặc điểm di truyền cụ thể. Việc tuyển dụng đủ số lượng bệnh nhân bị biến đổi phân tử hiếm gặp cho thử nghiệm lâm sàng ngày càng trở nên khó khăn, do đó, phân tích dựa trên DL về hình ảnh H&E mô học có thể tạo điều kiện thuận lợi cho việc tuyển dụng thử nghiệm lâm sàng bằng cách đẩy nhanh và đơn giản hóa quy trình này. Ngoài ra, các hệ thống DL có thể được đào tạo để dự đoán đáp ứng điều trị trực tiếp từ hình ảnh mô bệnh học H&E, do đó về cơ bản tạo thành một lớp chẩn đoán đồng hành mới. Tuy nhiên, như một lời cảnh báo, 1 ). Các nghiên cứu trong tương lai là cần thiết để giải quyết những điểm này một cách cụ thể trong bối cảnh của các hệ thống DL trong ung thư học.
Tiến tới các hệ thống end-to-end
Các dấu ấn sinh học di truyền trong các khối u rắn hiếm khi tự kết thúc, thay vào đó, chúng có thể được sử dụng như một đại diện để dự đoán phản ứng với một phương pháp điều trị cụ thể. Trong trường hợp tốt nhất, dấu hiệu di truyền thay thế có liên quan về mặt cơ học với một phương pháp điều trị cụ thể và mang lại giá trị tiên đoán dương tính cao cho đáp ứng điều trị. Ví dụ, đột biến hoặc biểu hiện quá mức HER2 trong ung thư vú dự báo phản ứng tích cực với trastuzumab. 4 Tuy nhiên, tình hình đối với nhiều dấu ấn sinh học phân tử khác không rõ ràng như vậy. Ví dụ, sự biểu hiện quá mức của PD-L1 trong mô khối u không có giá trị tiên đoán dương tính hoàn hảo cho đáp ứng với điều trị kháng PD1 / PD-L1 trong ung thư phổi. 55Do đó, các hệ thống DL đầu cuối đã được đề xuất như một cách tiếp cận thay thế, nhằm mục đích dự đoán phản ứng điều trị trực tiếp từ hình ảnh. Đáp ứng với điều trị ung thư thường được đánh giá thông qua “Tiêu chí đánh giá đáp ứng trong khối u rắn” (RECIST), và các tiêu chí này đã được sử dụng để đào tạo trực tiếp mạng lưới DL. Trong những trường hợp này, trạng thái RECIST là nhãn sự thật cơ bản được dự đoán từ hình ảnh. Tổng quát hơn, hệ thống DL đầu cuối tiên lượng dự đoán khả năng sống sót cho từng bệnh nhân dựa trên hình ảnh mô học mà không tập trung vào một loại điều trị cụ thể. Các hệ thống end-to-end như vậy về mặt lý thuyết có thể tốt hơn các dấu ấn sinh học tiên lượng hoặc tiên lượng phân tử, vì chúng sẽ có tiềm năng dự đoán kết quả trực tiếp từ hình ảnh mô học mà không cần tập trung vào một thông số dự đoán được xác định trước.
Thật không may, nhóm thuần tập bệnh nhân cần thiết cho các hệ thống DL đầu cuối dự đoán hiện không thể đạt được đối với hầu hết các nhà nghiên cứu. Sự hợp tác giữa các bác sĩ lâm sàng, nhà nghiên cứu bệnh lý và các nhà nghiên cứu DL là chìa khóa cho sự phát triển của các hệ thống như vậy trong tương lai.
Quan điểm
Trong vòng chưa đầy 2 năm kể từ lần xuất bản đầu tiên về xét nghiệm di truyền dựa trên DL, việc áp dụng DL tiên tiến trong mô bệnh học đã phát triển theo cấp số nhân, hứa hẹn tác động lâm sàng trên nhiều tình huống. Bài báo này cung cấp một cái nhìn tổng quan và so sánh định lượng các ứng dụng khác nhau của công nghệ này. Đáng lưu ý, các tiêu chuẩn chất lượng trong mô bệnh học DL được áp dụng lâm sàng vẫn đang tiếp tục phát triển. Như trong Bảng 1 và Bảng 2, có sự khác biệt rõ rệt về đánh giá bên ngoài và báo cáo các biện pháp thống kê giữa các nghiên cứu khác nhau. Để chuyển các phương pháp DL sang ứng dụng lâm sàng, xác nhận bên ngoài phải là nền tảng của các nghiên cứu trong tương lai. Ngoài ra, báo cáo minh bạch về số lượng bệnh nhân, các slide và nhóm thuần tập được đưa vào phân tích cũng như tiết lộ một loạt các biện pháp thống kê nên trở thành tiêu chuẩn trong lĩnh vực này.
Hầu hết các bộ phân loại DL vẫn yêu cầu tăng hiệu suất để đạt được độ tin cậy cần thiết để ứng dụng trong quy trình làm việc lâm sàng như là các công cụ kiểm tra cuối cùng. Những cải tiến như vậy có thể được mang lại bởi ba động lực chính: sự sẵn có của bộ dữ liệu lớn hơn với các chú thích lâm sàng 23 và những cải tiến trong cả phần cứng và thuật toán. Loại dấu ấn sinh học mới này có tiềm năng thay đổi quy trình làm việc lâm sàng trong lĩnh vực ung thư trong vài năm tới, nhưng các thử nghiệm đa trung tâm quy mô lớn là cần thiết để xác minh xem liệu phương pháp này có thể đáp ứng được những hy vọng này hay không.
Người giới thiệu
- 1.Petrelli, F., Ghidini, M., Cabiddu, M., Pezzica, E., Corti, D., Turati, L. và cộng sự. Sự không ổn định và khả năng sống sót của tế bào vi mô trong ung thư đại trực tràng giai đoạn II: một tổng quan hệ thống và phân tích tổng hợp. Chống ung thư Res. 39 , 6431–6441 (2019).
CAS PubMed Bài báo PubMed Central Google Scholar
- 2.Le, DT, Durham, JN, Smith, KN, Wang, H., Bartlett, BR, Aulakh, LK và cộng sự. Sự thiếu hụt sửa chữa không phù hợp dự đoán phản ứng của các khối u rắn đối với phong tỏa PD-1. Khoa học 357 , 409–413 (2017).
CAS PubMed PubMed Central Bài báo Google Scholar
- 3.Naito, Y. & Urasaki, T. Thuốc chính xác trong ung thư vú. Cái cằm. Clin. Oncol. 7 , 29 (2018).
PubMed Bài báo PubMed Central Google Scholar
- 4.Costa, RLB & Czerniecki, BJ Phát triển lâm sàng liệu pháp miễn dịch cho ung thư vú HER2 +: đánh giá các kháng thể đơn dòng hướng HER2 và hơn thế nữa. npj Ung thư vú 6 , 10 (2020).
CAS PubMed PubMed Central Bài báo Google Scholar
- 5.Mayekar, MK & Bivona, TG Bối cảnh hiện tại của liệu pháp nhắm mục tiêu trong ung thư phổi. Clin. Pharmacol. Họ. 102 , 757–764 (2017).
PubMed Bài báo PubMed Central Google Scholar
- 6.Geng, F., Wang, Z., Yin, H., Yu, J. & Cao, B. Thuốc nhắm mục tiêu phân tử và điều trị ung thư đại trực tràng: tiến bộ gần đây và triển vọng tương lai. Biother ung thư. Thuốc phóng xạ. 32 , 149–160 (2017).
CAS PubMed Bài báo PubMed Central Google Scholar
- 7.Lim, SM, Hong, MH & Kim, HR Miễn dịch liệu pháp điều trị ung thư phổi không tế bào nhỏ: bối cảnh hiện tại và viễn cảnh tương lai. Netw miễn dịch. 20 , e10 (năm 2020).
PubMed PubMed Central Bài báo Google Scholar
- số 8.Hiley, CT, Le Quesne, J., Santis, G., Sharpe, R., de Castro, DG, Middleton, G. et al. Những thách thức trong xét nghiệm phân tử ở bệnh nhân ung thư phổi không tế bào nhỏ với bệnh giai đoạn cuối. Lancet 388 , 1002–1011 (2016).
PubMed Bài báo PubMed Central Google Scholar
- 9.Kim, SY & Kim, TW Những thách thức hiện tại trong việc triển khai phương pháp điều trị ung thư chính xác để quản lý ung thư đại trực tràng di căn. ESMO Open 5 , https://doi.org/10.1136/esmoopen-2019-000634 (2020).
- 10.Diaz, LA, Le, DT, Yoshino, T., André, T., Bendell, JC, Rosales, M. et al. KEYNOTE-177: giai đoạn 3, nhãn mở, nghiên cứu ngẫu nhiên về ung thư biểu mô tuyến đầu di căn pembrolizumab (Pembro) so với hóa trị liệu do điều tra viên lựa chọn đối với sự thiếu hụt sửa chữa không phù hợp (dMMR) hoặc vi tế bào không ổn định cao (MSI-H) ung thư biểu mô trực tràng di căn (mCRC) . J. Clin. Chỉnh hình. 36 , TPS877 – TPS877 (2018).
Google Scholar
- 11.Coleman, RL, Oza, AM, Lorusso, D., Aghajanian, C., Oaknin, A., Dean, A. et al. Điều trị duy trì bằng Rucaparib đối với ung thư biểu mô buồng trứng tái phát sau khi đáp ứng với liệu pháp bạch kim (ARIEL3): một thử nghiệm giai đoạn 3 ngẫu nhiên, mù đôi, có đối chứng với giả dược. Lancet 390 , 1949–1961 (2017).
CAS PubMed PubMed Central Bài báo Google Scholar
- 12.Cocco, E., Scaltriti, M. & Drilon, A. Các bệnh ung thư dương tính với dung hợp NTRK và liệu pháp ức chế TRK. Nat. Linh mục Clin. Oncol. 15 , 731–747 (2018).
CAS PubMed PubMed Central Bài báo Google Scholar
- 13.Peters, S., Camidge, DR, Shaw, AT, Gadgeel, S., Ahn, JS, Kim, D.-W. et al. Alectinib so với crizotinib trong ung thư phổi không tế bào nhỏ có ALK dương tính không được điều trị. N. Engl. J. Med. 377 , 829–838 (2017).
CAS PubMed Bài báo Google Scholar
- 14.Moro-Sibilot, D., Cozic, N., Pérol, M., Mazières, J., Otto, J., Souquet, PJ và cộng sự. Crizotinib trong NSCLC dương tính với c-MET hoặc ROS1: kết quả của thử nghiệm AcSé giai đoạn II. Ann. Oncol. https://doi.org/10.1093/annonc/mdz407 (2019).
- 15.Ardila, D., Kiraly, AP, Bharadwaj, S., Choi, B., Reicher, JJ, Peng, L. và cộng sự. Tầm soát ung thư phổi giai đoạn cuối với học sâu ba chiều trên chụp cắt lớp vi tính vùng ngực liều thấp. Nat. Med. 25 , 954–961 (2019).
CAS PubMed Bài báo Google Scholar
- 16.Lundervold, AS & Lundervold, A. Tổng quan về học sâu trong hình ảnh y tế tập trung vào MRI. Z. Med. Thể chất. 29 , 102–127 (2019).
PubMed Bài báo Google Scholar
- 17.Yamada, M., Saito, Y., Imaoka, H., Saiko, M., Yamada, S., Kondo, H. et al. Phát triển hệ thống hỗ trợ chẩn đoán hình ảnh nội soi thời gian thực sử dụng công nghệ học sâu trong nội soi đại tràng. Khoa học. Đại diện. 9 , 14.465 (2019).
PubMed PubMed Central Bài báo CAS Google Scholar
- 18.Luo, H., Xu, G., Li, C., He, L., Luo, L., Wang, Z. et al. Trí tuệ nhân tạo thời gian thực để phát hiện ung thư đường tiêu hóa trên bằng nội soi: một nghiên cứu chẩn đoán đa trung tâm, bệnh chứng, đa trung tâm. Lancet Oncol. https://doi.org/10.1016/S1470-2045(19)30637-0 (2019).
- 19.Yap, J., Yolland, W. & Tschandl, P. Phân loại tổn thương da đa phương thức sử dụng học sâu. Hết hạn. Dermatol. 27 , 1261–1267 (2018).
PubMed Bài báo PubMed Central Google Scholar
- 20.Haenssle, HA, Fink, C., Schneiderbauer, R., Toberer, F., Buhl, T., Blum, A. et al. Người đàn ông chống lại máy móc: hiệu suất chẩn đoán của mạng nơ-ron phức hợp học sâu để nhận dạng khối u ác tính qua nội soi so với 58 bác sĩ da liễu. Ann. Oncol. 29 , 1836–1842 (2018).
CAS PubMed Bài báo Google Scholar
- 21.Fassler, DJ, Abousamra, S., Gupta, R., Chen, C., Zhao, M., Paredes, D. et al. Phương pháp phân tích hình ảnh dựa trên học tập sâu cho hình ảnh hóa mô miễn dịch đa hợp thu được từ trường sáng. Chẩn đoán. Pathol. 15 , 100 (năm 2020).
CAS PubMed PubMed Central Bài báo Google Scholar
- 22.Hermsen, M., de Bel, T., den Boer, M., Steenbergen, EJ, Kers, J., Florquin, S. et al. Đánh giá mô bệnh học dựa trên học sâu của mô thận. Mứt. Soc. Nephrol. 30 , 1968–1979 (2019).
PubMed PubMed Central Bài báo Google Scholar
- 23.Campanella, G., Hanna, MG, Geneslaw, L., Miraflor, A., Werneck Krauss Silva, V., Busam, KJ và cộng sự. Bệnh lý tính toán cấp độ lâm sàng sử dụng học sâu được giám sát yếu trên toàn bộ hình ảnh slide. Nat. Med. 25 , 1301–1309 (2019).
CAS PubMed PubMed Central Bài báo Google Scholar
- 24.Bulten, W., Pinckaers, H., van Boven, H., Vink, R., de Bel, T., van Ginneken, B. et al. Hệ thống học sâu tự động để phân loại ung thư tuyến tiền liệt của Gleason bằng cách sử dụng sinh thiết: một nghiên cứu chẩn đoán. Lancet Oncol. 21 , 233–241 (2020).
PubMed Bài báo Google Scholar
- 25.Ström, P., Kartasalo, K., Olsson, H., Solorzano, L., Delahunt, B., Berney, DM và cộng sự. Trí tuệ nhân tạo để chẩn đoán và phân loại ung thư tuyến tiền liệt trong sinh thiết: một nghiên cứu chẩn đoán dựa trên dân số. Lancet Oncol. 21 , 222–232 (2020).
PubMed Bài báo Google Scholar
- 26.Coudray, N., Ocampo, PS, Sakellaropoulos, T., Narula, N., Snuderl, M., Fenyö, D. et al. Phân loại và dự đoán đột biến từ hình ảnh mô bệnh học ung thư phổi không tế bào nhỏ bằng cách sử dụng học sâu. Nat. Med. 24 , 1559–1567 (2018).
CAS PubMed Bài báo Google Scholar
- 27.Kather, JN, Pearson, AT, Halama, N., Jäger, D., Krause, J., Loosen, SH et al. Học sâu có thể dự đoán sự bất ổn của tế bào vi mô trực tiếp từ mô học trong ung thư đường tiêu hóa. Nat. Med. 25 , 1054–1056 (2019).
CAS PubMed PubMed Central Bài báo Google Scholar
- 28.Cruz-Roa, A., Gilmore, H., Basavanhally, A., Feldman, M., Ganesan, S., Shih, NNC et al. Phát hiện ung thư vú xâm lấn chính xác và có thể tái tạo trong hình ảnh toàn bộ trang chiếu: một phương pháp học sâu để xác định mức độ của khối u. Khoa học. Bản 7 , https://doi.org/10.1038/srep46450 (2017).
- 29.Wang, X., Chen, H., Gan, C., Lin, H., Dou, Q., Tsougenis, E. et al. Học sâu được giám sát yếu để phân tích hình ảnh ung thư phổi toàn bộ slide. IEEE Trans. Cybern . https://doi.org/10.1109/TCYB.2019.2935141 (2019).
- 30.Falk, T., Mai, D., Bensch, R., Çiçek, Ö., Abdulkadir, A., Marrakchi, Y. et al. U-Net: học sâu để đếm, phát hiện và đo hình thái tế bào. Nat. Phương pháp 16 , 67–70 (2019).
CAS PubMed Bài báo PubMed Central Google Scholar
- 31.Shahin, AI, Guo, Y., Amin, KM & Sharawi, AA Hệ thống nhận dạng tế bào bạch cầu dựa trên mạng lưới học tập thần kinh sâu phức hợp. Tính toán. Các chương trình Phương pháp Y sinh. 168 , 69–80 (2019).
CAS PubMed Bài báo PubMed Central Google Scholar
- 32.McKinney, SM, Sieniek, M., Godbole, V., Godwin, J., Antropova, N., Ashrafian, H. et al. Đánh giá quốc tế về một hệ thống AI để tầm soát ung thư vú. Nature 577 , 89–94 (2020).
CAS PubMed Bài báo PubMed Central Google Scholar
- 33.Batc started, E., Loewer, A. & Lahav, G. Những thăng trầm của p53: hiểu động lực học của protein trong các tế bào đơn lẻ. Nat. Rev. Cancer 9 , 371–377 (2009).
CAS PubMed PubMed Central Bài báo Google Scholar
- 34.Schneider, G., Schmidt-Supprian, M., Rad, R. & Saur, D. Sự hình thành khối u cụ thể ở mô: vấn đề bối cảnh. Nat. Rev. Cancer 17 , 239–253 (2017).
CAS PubMed PubMed Central Bài báo Google Scholar
- 35.Mueller, MM & Fusenig, NE Bạn bè hoặc tác dụng lưỡng cực của kẻ thù của khối u trong ung thư. Nat. Rev. Cancer 4 , 839–849 (2004).
CAS PubMed Bài báo PubMed Central Google Scholar
- 36.Schaumberg, AJ, Rubin, MA, Fuchs, TJ H & E toàn bộ hình ảnh trang chiếu được nhuộm màu deep learning dự đoán trạng thái đột biến SPOP trong ung thư tuyến tiền liệt. In trước tại https://www.biorxiv.org/content/10.1101/064279v9 (2018).
- 37.Kim, RH, Nomikou, S., Dawood, Z., Jour, G., Donnelly, D., Moran, U. và cộng sự. Một cách tiếp cận học tập sâu để tầm soát đột biến nhanh chóng trong khối u ác tính. In trước tại https://www.biorxiv.org/content/10.1101/610311v1 (2019).
- 38Schmauch, B., Romagnoni, A., Pronier, E., Saillard, C., Maillé, P., Calderaro, J. et al. Mô hình học sâu để dự đoán biểu hiện RNA-Seq của khối u từ toàn bộ hình ảnh slide. Nat. Commun . 11 , https://doi.org/10.1038/s41467-020-17678-4 (2020).
- 39.Kather, JN, Heij, LR, Grabsch, HI, Loeffler, C., Echle, A., Muti, HS et al. Phát hiện dựa trên hình ảnh Pan-ung thư của những thay đổi di truyền có thể hành động trên lâm sàng. Nat. Cự Giải https://doi.org/10.1038/s43018-020-0087-6 (2020).
- 40.Fu, Y., Jung, AW, Torne, RV, Gonzalez, S., Vohringer, H., Jimenez-Linan, M. et al. Mô bệnh học tính toán ung thư Pan-ung thư cho thấy các đột biến, thành phần khối u và tiên lượng. In trước tại https://www.biorxiv.org/content/10.1101/813543v1 (2019).
- 41.Glynne-Jones, R., Wyrwicz, L., Tiret, E., Brown, G., Rodel, C., Cervantes, A. et al. Ung thư trực tràng: Hướng dẫn thực hành lâm sàng ESMO để chẩn đoán, điều trị và theo dõi. Ann. Oncol. 28 (Suppl 4), iv22–40 (2017).
- 42.Modest, DP, Martens, UM, Riera-Knorrenschild, J., Greeve, J., Florschütz, A., Wessendorf, S. et al. FOLFOXIRI kết hợp với panitumumab là phương pháp điều trị đầu tiên đối với ung thư đại trực tràng di căn kiểu hoang dại RAS: nghiên cứu ngẫu nhiên, nhãn mở, giai đoạn II VOLFI (AIO KRK0109). J. Clin. Oncol . 35 , 3401–3411 (2019).
Bài báo Google Scholar
- 43.Templeton, AJ, McNamara, MG, Šeruga, B., Vera-Badillo, FE, Aneja, P., Ocaña, A. et al. Vai trò tiên lượng của tỷ lệ bạch cầu trung tính trên tế bào lympho trong các khối u đặc: một tổng quan hệ thống và phân tích tổng hợp. J. Natl Cancer Inst. 106 , dju124 (2014).
PubMed Bài báo CAS PubMed Central Google Scholar
- 44.Kleppe, A., Albregtsen, F., Vlatkovic, L., Pradhan, M., Nielsen, B., Hveem, TS và cộng sự. Tổ chức nhiễm sắc và tiên lượng ung thư: một nghiên cứu ung thư toàn thể. Lancet Oncol. 19 , 356–369 (2018).
CAS PubMed PubMed Central Bài báo Google Scholar
- 45.Kather, JN, Krisam, J., Charoentong, P., Luedde, T., Herpel, E., Weis, C.-A. et al. Dự đoán khả năng sống sót sau các slide mô học ung thư đại trực tràng sử dụng học sâu: một nghiên cứu đa trung tâm hồi cứu. PLoS Med. 16 , e1002730 (2019).
PubMed PubMed Central Bài báo CAS Google Scholar
- 46.Courtiol, P., Maussion, C., Moarii, M., Pronier, E., Pilcer, S., Sefta, M. et al. Phân loại ung thư trung biểu mô dựa trên học tập sâu cải thiện dự đoán kết quả của bệnh nhân. Nat. Med . https://doi.org/10.1038/s41591-019-0583-3 (2019).
- 47.Muhammad, H., Sigel, CS, Campanella, G., Boerner, T., Pak, LM, Büttner, S. et al. Hướng tới phân loại ung thư không được giám sát: dự đoán tiên lượng bằng từ điển hình ảnh mô học. In trước tại http://arxiv.org/abs/1903.05257 (2019).
- 48.Bychkov, D., Linder, N., Turkki, R., Nordling, S., Kovanen, PE, Verrill, C. et al. Phân tích mô dựa trên học tập sâu dự đoán kết quả của ung thư đại trực tràng. Khoa học. Phiên bản 8 , 3395 (2018).
PubMed PubMed Central Bài báo CAS Google Scholar
- 49.Kulkarni, PM, Robinson, EJ, Sarin Pradhan, J., Gartrell-Corrado, RD, Rohr, BR, Trager, MH và cộng sự. Học sâu dựa trên hình ảnh H&E tiêu chuẩn của các khối u hắc tố nguyên phát xác định bệnh nhân có nguy cơ tái phát nội tạng và tử vong. Clin. Ung thư Res. https://doi.org/10.1158/1078-0432.CCR-19-1495 (2019).
- 50.Sparano, JA, Grey, RJ, Makower, DF, Pritchard, KI, Albain, KS, Hayes, DF và cộng sự. Hóa trị bổ trợ được hướng dẫn bởi một xét nghiệm biểu hiện gen 21 ở bệnh ung thư vú. N. Engl. J. Med. 379 , 111–121 (2018).
CAS PubMed PubMed Central Bài báo Google Scholar
- 51.Harder, N., Schönmeyer, R., Nekolla, K., Meier, A., Brieu, N., Vanegas, C. et al. Tự động phát hiện các chữ ký dựa trên hình ảnh để dự đoán phản ứng ipilimumab trong u hắc tố ác tính. Khoa học. Bản đại diện 9 , https://doi.org/10.1038/s41598-019-43525-8 (2019).
- 52.Madabhushi, A., Wang, X., Barrera, C. & Velcheti, V. Dự đoán phản ứng với liệu pháp miễn dịch bằng cách sử dụng máy tính trích xuất các đặc điểm của nhân ung thư từ hình ảnh nhuộm hematoxylin và eosin (H&E) của ung thư phổi không tế bào nhỏ (NSCLC). Bằng sáng chế US. http://www.freepatentsonline.com/y2019/0259154.html (2019).
- 53.X quang AI | Aidoc luôn bật AI. Aidoc. https://www.aidoc.com/ (truy cập ngày 28 tháng 11 năm 2019).
- 54.Paige. https://paige.ai/ (truy cập ngày 2 tháng 4 năm 2020).
- 55.Tseng, J.-S., Yang, T.-Y., Wu, C.-Y., Ku, W.-H., Chen, K.-C., Hsu, K.-H. et al. Đặc điểm và giá trị tiên đoán của tình trạng PD-L1 ở bệnh nhân ung thư phổi không tế bào nhỏ trong thế giới thực. J. Miễn dịch. 41 , 292–299 (2018).
CAS PubMed Bài báo Google Scholar
- 56.Araújo, T., Aresta, G., Castro, E., Rouco, J., Aguiar, P., Eloy, C. et al. Phân loại hình ảnh mô học ung thư vú bằng cách sử dụng Mạng thần kinh chuyển đổi. PLoS ONE 12 , e0177544 (2017).
PubMed PubMed Central Bài báo CAS Google Scholar
- 57.Golatkar, A., Anand, D., Sethi, A. Phân loại mô học ung thư vú sử dụng học sâu. trong Phân tích và Nhận dạng Hình ảnh . Campilho, A., Karray, F., & ter Haar Romeny, B. (Eds) 837–844 (Springer International Publishing, 2018).
- 58.Rakhlin, A., Shvets, A., Iglovikov, V. & Kalinin, AA Mạng lưới thần kinh phức hợp sâu để phân tích hình ảnh mô học ung thư vú. trong Phân tích và Nhận dạng Hình ảnh . Campilho, A., Karray, F., & ter Haar Romeny, B. (Eds) 737–744 (Springer International Publishing, 2018).
- 59.Yang, Z., Ran, L., Zhang, S., Xia, Y. & Zhang, Y. EMS-Net: tập hợp các mạng nơ-ron phức hợp nhiều tầng để phân loại hình ảnh mô học ung thư vú. Máy tính thần kinh 366 , 46–53 (2019).
Bài báo Google Scholar
- 60.Chen, P.-HC, Gadepalli, K., MacDonald, R., Liu, Y., Kadowaki, S., Nagpal, K. và cộng sự. Kính hiển vi thực tế tăng cường tích hợp trí tuệ nhân tạo thời gian thực để chẩn đoán ung thư. Nat. Med. 25 , 1453–1457 (2019).
CAS PubMed Bài báo Google Scholar
- 61.Chuang, W.-Y., Chang, S.-H., Yu, W.-H., Yang, C.-K., Yeh, C.-J., Ueng, S.-H. et al. Xác định thành công ung thư biểu mô vòm họng trong sinh thiết vòm họng bằng phương pháp học sâu. Cancers 12 , https://doi.org/10.3390/cancers12020507 (2020).
- 62.Janowczyk, A. & Madabhushi, A. Học sâu để phân tích hình ảnh bệnh lý kỹ thuật số: hướng dẫn toàn diện với các trường hợp sử dụng được chọn. J. Pathol. Thông báo. 7 , 29 (2016).
PubMed PubMed Central Bài báo Google Scholar
- 63.Korbar, B., Olofson, AM, Miraflor, AP, Nicka, CM, Suriawinata, MA, Torresani, L. et al. Học sâu để phân loại polyp đại trực tràng trên hình ảnh toàn bộ slide. J. Pathol. Thông báo. 8 , 30 (2017).
PubMed PubMed Central Bài báo Google Scholar
- 64.Sirinukunwattana, K., Domingo, E., Richman, SD, Redmond, KL, Blake, A., Verrill, C. et al. Phân loại phân tử đồng thuận dựa trên hình ảnh (imCMS) của ung thư đại trực tràng bằng cách sử dụng học sâu. Gut https://doi.org/10.1136/gutjnl-2019-319866 (2020).
Bài báo PubMed Google Scholar
- 65.Kiani, A., Uyumazturk, B., Rajpurkar, P., Wang, A., Gao, R., Jones, E. et al. Tác động của một trợ lý học sâu đến phân loại mô bệnh học của ung thư gan. npj Số. Med. 3 , 23 (năm 2020).
PubMed PubMed Central Bài báo Google Scholar
- 66.Ianni, JD, Soans, RE, Sankarapandian, S., Chamarthi, RV, Ayyagari, D., Olsen, TG et al. Được thiết kế riêng cho thế giới thực: toàn bộ hệ thống phân loại hình ảnh trang trình bày được xác thực trên dữ liệu đa địa điểm không bão hòa mô phỏng khối lượng công việc bệnh lý tiềm năng. Khoa học. Bản 10 , 3217 (2020).
CAS PubMed PubMed Central Bài báo Google Scholar
- 67.Iizuka, O., Kanavati, F., Kato, K., Rambeau, M., Arihiro, K. & Tsuneki, M. Mô hình học sâu để phân loại mô bệnh học của các khối u biểu mô dạ dày và ruột kết. Khoa học. Rep. 10 , 1504 (2020).
CAS PubMed PubMed Central Bài báo Google Scholar
- 68.Xu, H., Park, S. & Hwang, TH Phân loại vi tính ung thư tuyến tiền liệt Điểm Gleason từ toàn bộ hình ảnh slide. IEEE / ACM Trans. Tính toán. Biol. Dạng sinh học . https://doi.org/10.1109/TCBB.2019.2941195 (2019).
- 69.Couture, HD, Williams, LA, Geradts, J., Nyante, SJ, Butler, EN, Marron, JS và cộng sự. Phân tích hình ảnh với học sâu để dự đoán loại ung thư vú, tình trạng ER, loại phụ mô học và loại phụ nội tại. npj Ung thư vú 4 , 30 (2018).
PubMed PubMed Central Bài báo Google Scholar
- 70.Noorbakhsh, J., Farahmand, S. & Soltanieh-ha, M. Pan-ung thư phân loại hình ảnh mô học khối u bằng cách sử dụng học sâu. In trước tại https://www.biorxiv.org/content/10.1101/715656v1 (2019).
- 71.Kather JN, Schulte J., Grabsch HI, Loeffler C., Muti HS Học sâu phát hiện sự hiện diện của vi rút trong mô học ung thư. In trước tại https://www.biorxiv.org/content/10.1101/690206v1 (2019).
- 72.Sun, M., Zhou, W., Qi, X., Zhang, G., Girnita, L., Seregard, S. et al. Dự đoán biểu hiện BAP1 trong u ác tính màng bồ đào bằng cách sử dụng các mạng lưới phân loại sâu được kết nối dày đặc. Cancers 11 , https://doi.org/10.3390/cancers11101579 (2019).
- 73.Zhang, H., Ren, F., Wang, Z., Rao, X., Li, L., Hao, J. et al. Dự đoán gánh nặng đột biến khối u từ hình ảnh bệnh lý ung thư gan bằng cách sử dụng mạng nơ-ron phức hợp. trong Hội nghị Quốc tế IEEE về Tin sinh học và Y sinh (BIBM) năm 2019 . 920–925 (IEEE, 2019).
- 74.Sha, L., Osinski, BL, Ho, IY, Tan, TL, Willis, C., Weiss, H. et al. Mô hình học sâu đa trường nhìn dự đoán trạng thái phối tử 1 được lập trình của ung thư phổi không tế bào nhỏ từ hình ảnh hematoxylin và eosin toàn trang. J. Pathol. Thông báo. 10 , 24 (2019).
PubMed PubMed Central Bài báo Google Scholar
- 75.Mobadersany, P., Yousefi, S., Amgad, M., Gutman, DA, Barnholtz-Sloan, JS, Velázquez Vega, JE và cộng sự. Dự đoán kết quả ung thư từ mô học và bộ gen bằng cách sử dụng mạng phức hợp. Proc. Natl Acad. Khoa học. Hoa Kỳ 115 , E2970 – E2979 (2018).
CAS PubMed PubMed Central Bài báo Google Scholar
- 76.Turkki, R., Byckhov, D., Lundin, M., Isola, J., Nordling, S., Kovanen, PE và cộng sự. Dự đoán kết quả ung thư vú với hình ảnh mô khối u và máy học. Ung thư vú Res. Đãi. 177 , 41–52 (2019).
PubMed PubMed Central Bài báo Google Scholar
- 77.Shaban, M., Khurram, SA, Fraz, MM, Alsubaie, N., Masood, I., Mushtaq, S. et al. Một điểm số mới cho sự phong phú của các tế bào lympho thâm nhiễm khối u dự đoán khả năng sống sót không mắc bệnh trong ung thư biểu mô tế bào vảy ở miệng. Khoa học. Rep. 9 , 13341 (2019).
PubMed PubMed Central Bài báo CAS Google Scholar
- 78.Skrede, O.-J., De Raedt, S., Kleppe, A., Hveem, TS, Liestøl, K., Maddison, J. et al. Học sâu để dự đoán kết quả ung thư đại trực tràng: một nghiên cứu khám phá và xác nhận. Lancet 395 , 350–360 (2020).
CAS PubMed Bài báo Google Scholar
- 79.Zadeh Shirazi, A., Fornaciari, E., Bagherian, NS, Ebert, LM, Koszyca, B. & Gomez, GA DeepSurvNet: mạng phức hợp sống sót sâu để phân loại tỷ lệ sống sót ung thư não dựa trên hình ảnh mô bệnh học. Med. Biol. Anh Tính toán. https://doi.org/10.1007/s11517-020-02147-3 (2010).
- 80.Saillard, C., Schmauch, B., Laifa, O., Moarii, M., Toldo, S., Zaslavskiy, M. et al. Dự đoán khả năng sống sót sau khi cắt bỏ ung thư biểu mô tế bào gan bằng cách sử dụng học sâu trên các slide mô học. Gan mật https://doi.org/10.1002/hep.31207 (2020).
- 81.Wulczyn, E., Steiner, DF, Xu, Z., Sadhwani, A., Wang, H. & Flament-Auvigne I. Dự đoán thời gian sống sót dựa trên học sâu cho nhiều loại ung thư bằng hình ảnh mô bệnh học. PLoS ONE 15 , e0233678 (2020).
CAS PubMed PubMed Central Bài báo Google Scholar
- 82.Collins, GS, Reitsma, JB, Altman, DG & Moons, KGM Báo cáo minh bạch về mô hình dự đoán đa biến cho tiên lượng hoặc chẩn đoán cá nhân (TRIPOD): tuyên bố TRIPOD. Br. J. Cancer 112 , 251–259 (2015).
CAS PubMed PubMed Central Bài báo Google Scholar
Tải xuống tài liệu tham khảo
Thông tin tác giả
Chi nhánh
- Khoa Y III, Bệnh viện Đại học RWTH Aachen, Aachen, Đức
Amelie Echle và Jakob Nikolas Kather
- Trung tâm Nghiên cứu Ung thư Đức (DKFZ), Heidelberg, Đức
Niklas Timon Rindtorff và Jakob Nikolas Kather
- Trung tâm Quốc gia về Bệnh khối u (NCT), Trung tâm Nghiên cứu Ung thư Đức (DKFZ), Heidelberg, Đức
Titus Josef Brinker
- Khoa tiêu hóa, gan mật và các bệnh truyền nhiễm, Bệnh viện Đại học Duesseldorf, Düsseldorf, Đức
Tom Luedde
- Bộ phận Huyết học / Ung thư, Khoa Y, Đại học Chicago, Chicago, IL, Hoa Kỳ
Alexander Thomas Pearson
Đóng góp
AE và JNK đã thiết kế ý tưởng của bài báo, thực hiện nghiên cứu và phân tích tài liệu. AE và JNK đã viết bản nháp đầu tiên của bài báo. NTR, TJB, TL và ATP đã sửa đổi nghiêm túc bài báo.
Đồng tác giả
Thư từ cho Jakob Nikolas Kather .
The online HTML, CSS and JavaScript organizers will take care of your dirty markup!