Hợp chất thí nghiệm giết chết ung thư, dự phòng cho các tế bào miễn dịch
Các nhà khoa học Tây Nam UT xác định N6F11 là phương pháp điều trị đầy hứa hẹn để nhắm vào các bệnh ung thư khác nhau
DALLAS – Ngày 20 tháng 2 năm 2024 – Các nhà nghiên cứu của Trung tâm Y tế Tây Nam UT đã xác định được một hợp chất giúp loại bỏ có chọn lọc các tế bào ung thư trong khi tránh các tế bào miễn dịch dưới dạng chết tế bào được gọi là ferroptosis. Những phát hiện, được công bố trên Science Translational Medicine, có thể dẫn đến các phương pháp điều trị mới cho nhiều loại ung thư, các tác giả nghiên cứu cho biết.

“Nghiên cứu của chúng tôi là nghiên cứu đầu tiên báo cáo cảm ứng ferroptosis đặc hiệu cho tế bào ung thư”, Daolin Tang, MD, Ph.D., Giáo sư Phẫu thuật tại UT Southwestern, người đồng dẫn đầu nghiên cứu với Rui Kang, MD, Ph.D., Phó Giáo sư Phẫu thuật tại UT Southwestern. Bác sĩ Tang và Kang là thành viên của Trung tâm Ung thư Toàn diện Harold C. Simmons.
Chỉ hơn một thập kỷ trước, các nhà nghiên cứu ở những nơi khác đã phát hiện ra ferroptosis, một loại chết tế bào đặc trưng bởi sự tích tụ một lượng lớn sắt và peroxy hóa lipid không kiểm soát được. Bởi vì một số loại ung thư phát triển đề kháng với thuốc hóa trị, việc tìm cách thúc đẩy ferroptosis nhanh chóng trở thành trọng tâm của nghiên cứu ung thư quan trọng, Tiến sĩ Tang giải thích.
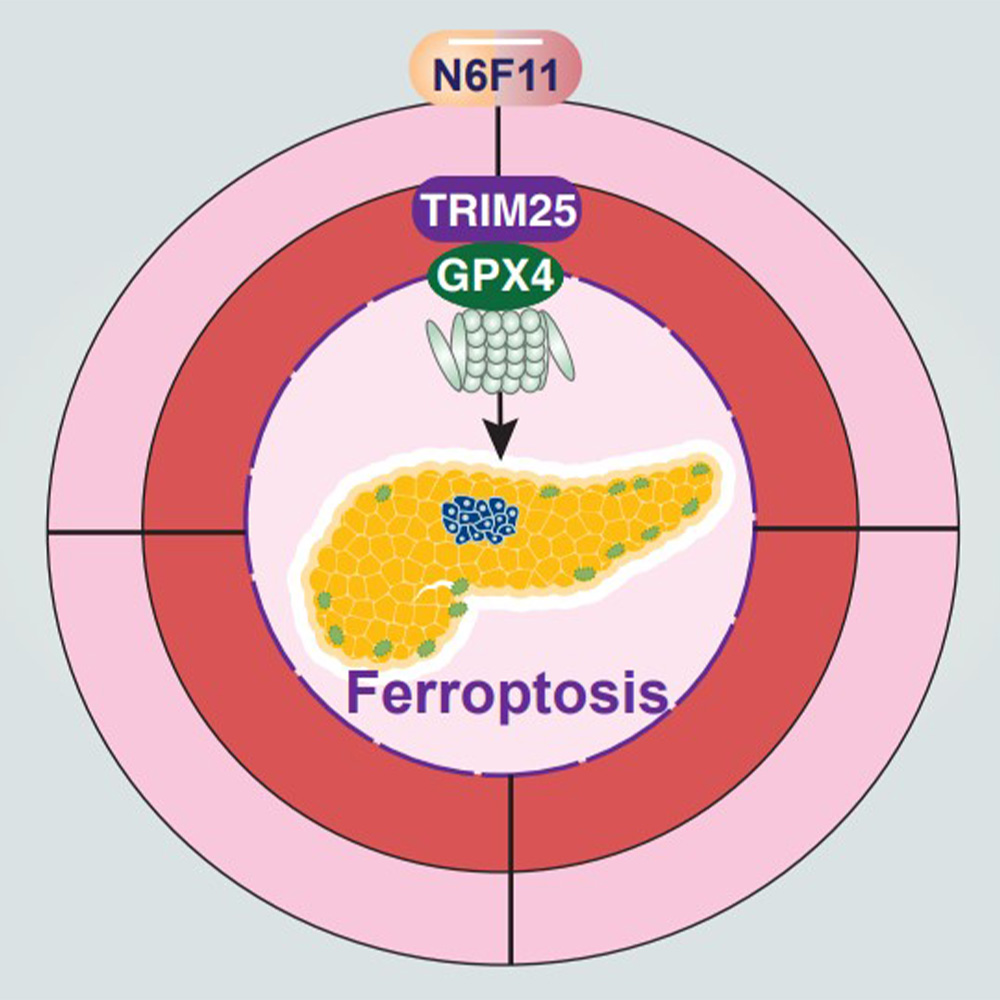
Hầu hết những nỗ lực này tập trung vào việc ức chế một enzyme chống oxy hóa gọi là GPX4, một chất ức chế bậc thầy của ferroptosis. Tuy nhiên, Tiến sĩ Tang cho biết, các hợp chất ức chế GPX4 được xác định cho đến nay không chỉ gây ra ferroptosis trong tế bào ung thư mà còn ở nhiều loại tế bào miễn dịch – gây ra tác dụng phụ ở động vật thí nghiệm đồng thời cản trở phản ứng chống ung thư tự nhiên của hệ thống miễn dịch.

Tìm kiếm một hợp chất chỉ nhắm mục tiêu GPX4 trong các tế bào ung thư, Tiến sĩ Tang và Kang và các đồng nghiệp của họ đã sàng lọc hơn 4.200 hợp chất từ thư viện thuốc của một công ty dược phẩm, định lượng các tế bào ung thư tuyến tụy ở người phát triển trong đĩa petri. Những thí nghiệm này phát hiện ra rằng một hợp chất gọi là N6F11 không chỉ làm giảm lượng GPX4 có trong tế bào mà còn dễ dàng khiến các tế bào này chết vì ferroptosis. Gần một nửa số tế bào đã chết trong vòng 12 giờ. Các nhà nghiên cứu đã có kết quả tương tự khi họ dùng N6F11 liều các loại tế bào ung thư khác, bao gồm bàng quang, vú và cổ tử cung.
Các thí nghiệm bổ sung cho thấy N6F11 liên kết với một protein khác gọi là TRIM25, điều chỉnh lượng GPX4 và các protein khác và đặc biệt phong phú trong các tế bào ung thư. Sự liên kết đó thúc đẩy TRIM25 gắn thẻ GPX4 với ubiquitin, một protein hướng GPX4 đến các bãi rác di động nơi nó bị phân hủy. Khi GPX4 biến mất, các tế bào chết vì ferroptosis.
Thử nghiệm sâu hơn trên các mô hình chuột bị ung thư tuyến tụy cho thấy N6F11 không chỉ hầu như ngăn chặn sự tiến triển của ung thư, Tiến sĩ Tang nói, mà nó còn dường như không độc hại đối với các mô hoặc tế bào khỏe mạnh. Các tác dụng phụ ức chế miễn dịch được thấy trong nghiên cứu trước đây tập trung vào việc ức chế GPX4 không có với N6F11. Trong giai đoạn tiếp theo, các nhà nghiên cứu đã cho động vật kết hợp N6F11 và một phương pháp điều trị ung thư được gọi là chất ức chế điểm kiểm soát miễn dịch thường được sử dụng ở bệnh nhân. Sự kết hợp này cải thiện đáng kể tỷ lệ sống sót của chúng so với những con chuột được điều trị riêng biệt.
Nghiên cứu trong tương lai sẽ tập trung vào việc phát triển N6F11 thành một loại thuốc khả thi – một quá trình có thể mất vài năm – cũng như tìm kiếm các loại thuốc đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ phê duyệt cho những loại hoạt động tương tự như N6F11, sẽ đòi hỏi ít thời gian và tiền bạc hơn, Tiến sĩ Tang nói.
Các nhà nghiên cứu khác của UTSW đã đóng góp cho nghiên cứu này là Zhuan Zhou, Tiến sĩ, Trợ lý Giáo sư Da liễu, và Chunhua Yu, MD, Tiến sĩ, Giám đốc Phòng thí nghiệm Tang.
Nghiên cứu này được tài trợ bởi Viện Y tế Quốc gia (R01CA160417, R01CA229275 và R01CA211070).
Về UT Southwestern Medical Center
UT Southwestern, một trong những trung tâm y tế học thuật hàng đầu của quốc gia, tích hợp nghiên cứu y sinh tiên phong với chăm sóc lâm sàng và giáo dục đặc biệt. Các giảng viên của tổ chức đã nhận được sáu giải thưởng Nobel và bao gồm 25 thành viên của Viện Hàn lâm Khoa học Quốc gia, 21 thành viên của Học viện Y khoa Quốc gia và 13 Điều tra viên của Viện Y khoa Howard Hughes. Các giảng viên toàn thời gian của hơn 3.100 chịu trách nhiệm cho những tiến bộ y tế đột phá và cam kết dịch nghiên cứu dựa trên khoa học một cách nhanh chóng sang các phương pháp điều trị lâm sàng mới. Các bác sĩ của UT Southwestern cung cấp dịch vụ chăm sóc trong hơn 80 chuyên khoa cho hơn 120.000 bệnh nhân nhập viện, hơn 360.000 trường hợp phòng cấp cứu và giám sát gần 5 triệu lượt khám ngoại trú mỗi năm.


