CBG và những tác động chống lại ung thư, tăng nhãn áp và viêm ruột

Chống ung thư, một đặc tính của CBG
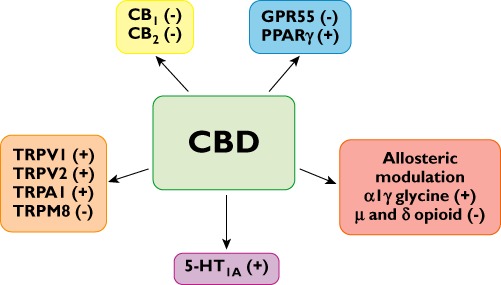
Cannabigerol (CBG) là một cannabinoid (CB) không có nguồn gốc từ Cannabis an toàn, tương tác với các mục tiêu cụ thể liên quan đến gây ung thư. Cụ thể, CBG có khả năng ngăn chặn tiềm năng thụ thể tạm thời (TRP) M8 (TRPM8), kích hoạt các kênh TRPA1, TRPV1 và TRPV2, chặn thụ thể 5-hydroxytryptamine 1A (5-HT1A) và ức chế tái hấp thu endocannabino. Ở đây, chúng tôi đã điều tra xem liệu CBG có bảo vệ chống lại u nguyên bào đại tràng hay không. Tăng trưởng tế bào được đánh giá trong các tế bào ung thư đại trực tràng (CRC) bằng cách sử dụng các xét nghiệm 3- (4,5-dimethylthiazole-2-yl) -2,5-diphenyl tetrazolium bromide và 3-amino-7-dimethylamino-2-methylphenazine hydrochloride; apoptosis được kiểm tra bằng mô học và bằng cách đánh giá hoạt động caspase 3/7; sản xuất các loại oxy phản ứng (ROS) bằng đầu dò huỳnh quang; Thụ thể CB, Biểu hiện RNA tương đồng protein TRP và CCAAT / protein tăng cường (CHOP) RNA (mRNA) được định lượng bằng phản ứng sao chép chuỗi polymerase ngược; Sự im lặng RNA-vector kẹp tóc nhỏ của TRPM8 đã được thực hiện bằng phương pháp điện di. Tác dụng chống ung thư in vivo của CBG được đánh giá bằng mô hình chuột ung thư ruột kết. Các tế bào CRC biểu hiện các thụ thể TRPM8, CB1, CB2, 5-HT1A, TRPA1, TRPV1 và TRPV2 mRNA. CBG thúc đẩy apoptosis, kích thích sản xuất ROS, điều hòa mRNA CHOP và giảm sự phát triển tế bào trong các tế bào CRC. Hiệu ứng CBG đối với sự phát triển của tế bào là độc lập với kích hoạt kênh TRPA1, TRPV1 và TRPV2, được tăng thêm bởi chất đối kháng thụ thể CB2 và được mô phỏng bởi các thuốc chẹn kênh TRPM8 khác nhưng không phải là chất đối kháng 5-HT1A. Hơn nữa, ảnh hưởng của CBG đối với sự phát triển của tế bào và biểu hiện CHOP mRNA đã giảm trong các tế bào im lặng TRPM8. In vivo, CBG ức chế sự phát triển của khối u xenograft cũng như gây ung thư ruột kết do hóa chất. CBG cản trở sự tiến triển ung thư ruột kết in vivo và ức chế chọn lọc sự phát triển của các tế bào CRC, một hiệu ứng được chia sẻ bởi các chất đối kháng TRPM8 khác. CBG nên được xem xét dịch trong phòng ngừa và chữa bệnh CRC.
Dùng điều trị trong tăng nhãn áp, CBG có tác dụng đáng kể CBD ít hơn
Trong khoảng thời gian vài thập kỷ, nhiều nghiên cứu khoa học đã chứng minh rằng, bất kể đường dùng, cannabinoids đều có thể làm giảm áp lực nội nhãn. Hơn nữa, các hợp chất này được đặc trưng bởi tính chất bảo vệ thần kinh và giãn mạch, chứng minh thêm rằng nó có ích trong điều trị bảo tồn bệnh tăng nhãn áp. Cho đến nay, nó vẫn chưa được mô tả chi tiết về cơ chế nào được sử dụng để giảm áp lực nội nhãn bằng cannabinoids. Tuy nhiên, sự hiện diện của các thụ thể endocannabinoid trong các cấu trúc của mắt chịu trách nhiệm cho sự hình thành và chảy ra của chất lỏng nước là một lời giải thích cho hiệu quả của các hợp chất này, khi được sử dụng ở dạng thuốc bôi.
CBG có đặc tính kháng khuẩn – một thử nghiệm từ dòng Sativa
Cần sa (Cannabis sativa) từ lâu đã được biết là có chứa cannabinoids kháng khuẩn, có khả năng giải quyết tình trạng kháng kháng sinh vẫn chưa được nghiên cứu. Tất cả năm loại cannabinoids chính (cannabidiol (1b), cannabichromene (2), cannabigerol (3b), Delta (9) -tetrahydrocannabinol (4b) và cannabinol (5) đều cho thấy hoạt tính mạnh đối với nhiều loại kháng methus. ) các chủng có liên quan lâm sàng hiện nay. Hoạt động có khả năng chịu đựng đáng kể với bản chất của moen prenyl, với vị trí tương đối của nó so với n-pentyl mo (cannabinoids bất thường) và carboxyl hóa của nửa resorcinyl (pre-cannabinoids). Ngược lại, methyl hóa và acetyl hóa các hydroxyl phenolic, ester hóa nhóm carboxylic của pre-cannabinoids, và giới thiệu một nửa prenyl thứ hai đều gây bất lợi cho hoạt động kháng khuẩn. Kết hợp lại với nhau, những quan sát này cho thấy rằng prenyl của cannabinoids đóng vai trò chủ yếu như một bộ điều biến ái lực lipid đối với lõi olivetol, một dược phẩm kháng khuẩn hoạt động kém, trong khi hiệu lực cao của chúng chắc chắn gợi ý một cơ chế hoạt động cụ thể, nhưng khó nắm bắt.
Tác dụng cụ thể đối với bệnh viêm ruột
Bệnh viêm đường ruột (IBD) là một căn bệnh nan y, ảnh hưởng đến hàng triệu người ở các nước công nghiệp. Bằng chứng giai thoại và khoa học cho thấy sử dụng Cần sa có thể có tác động tích cực ở bệnh nhân IBD. Ở đây, chúng tôi đã nghiên cứu tác dụng của cannabigerol (CBG), một loại cannabinoid có nguồn gốc từ Cannabis, trong một mô hình viêm đại tràng. Viêm đại tràng được gây ra ở chuột bằng cách sử dụng axit dinitrobenzene sulphonic (DNBS). Viêm được đánh giá bằng cách đánh giá các dấu hiệu / thông số viêm (tỷ lệ trọng lượng / chiều dài đại tràng và hoạt động myeloperoxidase), bằng phân tích mô học và hóa mô miễn dịch; interleukin-1β, interleukin-10 và nồng độ interferon-by bằng ELISA, nitric oxide synthase (iNOS) và cyclooxygenase-2 (COX-2) bằng phương pháp blot và RT-PCR; Hoạt tính CuZn-superoxide effutase (SOD) bằng xét nghiệm so màu. Các đại thực bào Murine và các tế bào biểu mô ruột được sử dụng để đánh giá tác động của CBG đối với việc sản xuất oxit nitric và stress oxy hóa. CBG giảm tỷ lệ trọng lượng / chiều dài đại tràng, hoạt động myeloperoxidase và biểu hiện iNOS, tăng hoạt động SOD và interleukin-1 bình thường, interleukin-10 và interferon-γ thay đổi liên quan đến quản trị DNBS. Trong các đại thực bào, CBG giảm sản xuất oxit nitric và biểu hiện protein iNOS (nhưng không phải mRNA). Rimonabant (chất đối kháng thụ thể CB1) không làm thay đổi tác dụng của CBG trong sản xuất oxit nitric, trong khi SR144528 (chất đối kháng thụ thể CB2) làm tăng thêm tác dụng ức chế của CBG đối với việc sản xuất oxit nitric. Kết luận, CBG suy giảm viêm đại tràng giảm sản xuất oxit nitric trong các đại thực bào (hiệu ứng được điều chế bởi thụ thể CB2) và giảm sự hình thành ROS trong các tế bào biểu mô ruột. CBG có thể được xem xét để thử nghiệm lâm sàng ở bệnh nhân IBD.